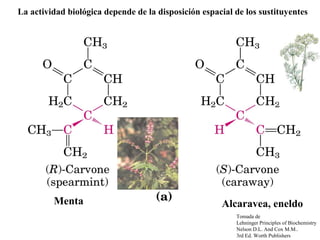
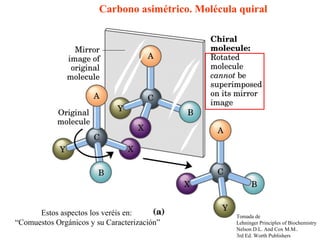
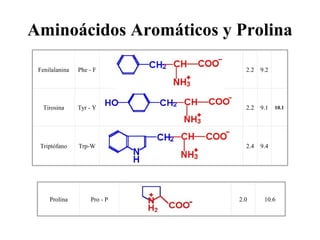
Este documento trata sobre los aminoácidos, péptidos y enlace peptídico. Explica que los aminoácidos son los bloques de construcción de las proteínas y están formados por un átomo de carbono alfa unido a un grupo amino, un grupo carboxilo y una cadena lateral variable. Además, solo 20 aminoácidos están codificados genéticamente y forman las proteínas mediante enlaces peptídicos entre sus grupos amino y carboxilo. Finalmente, el documento analiza conceptos como los aminoácidos esenciales,