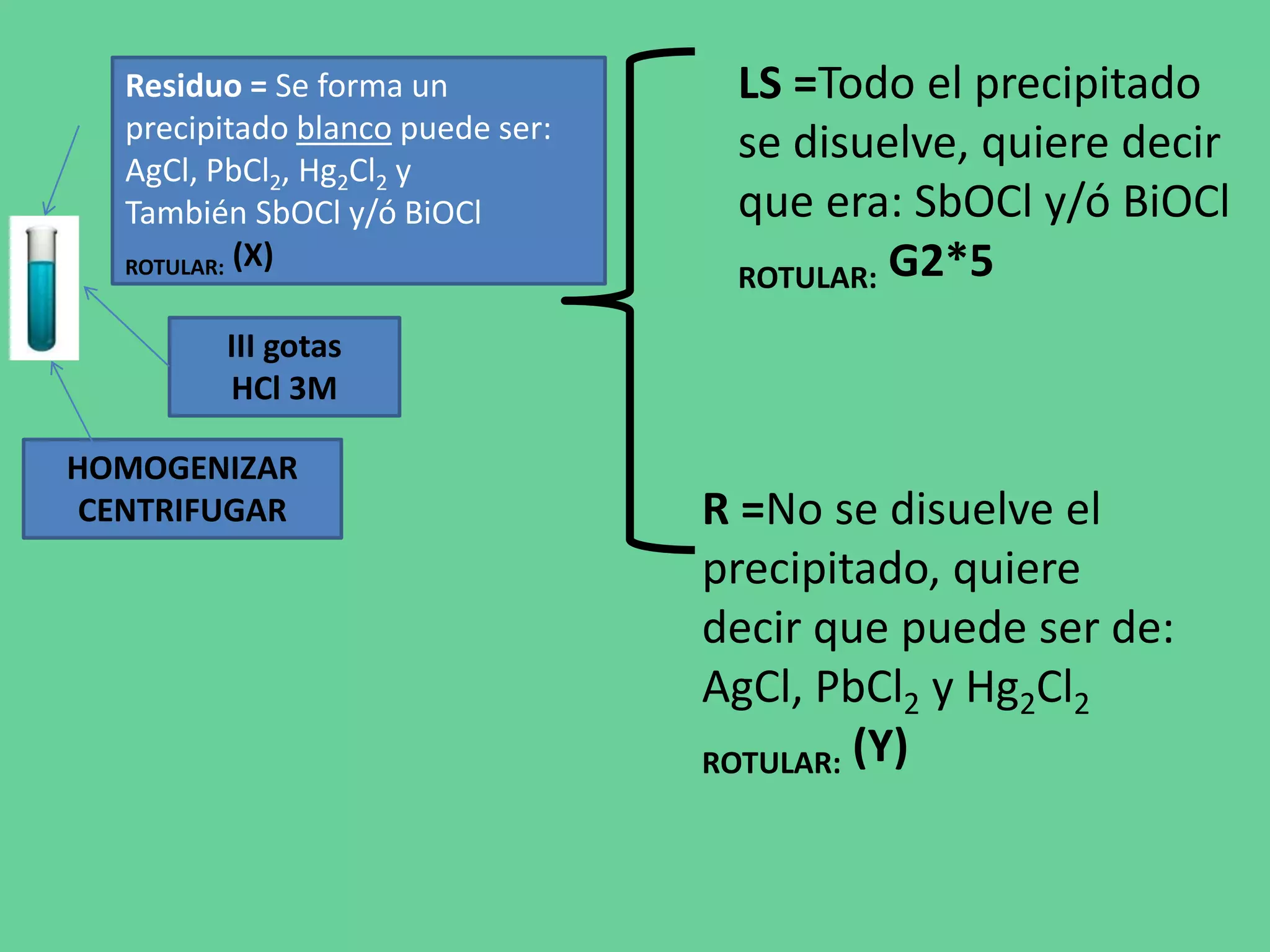
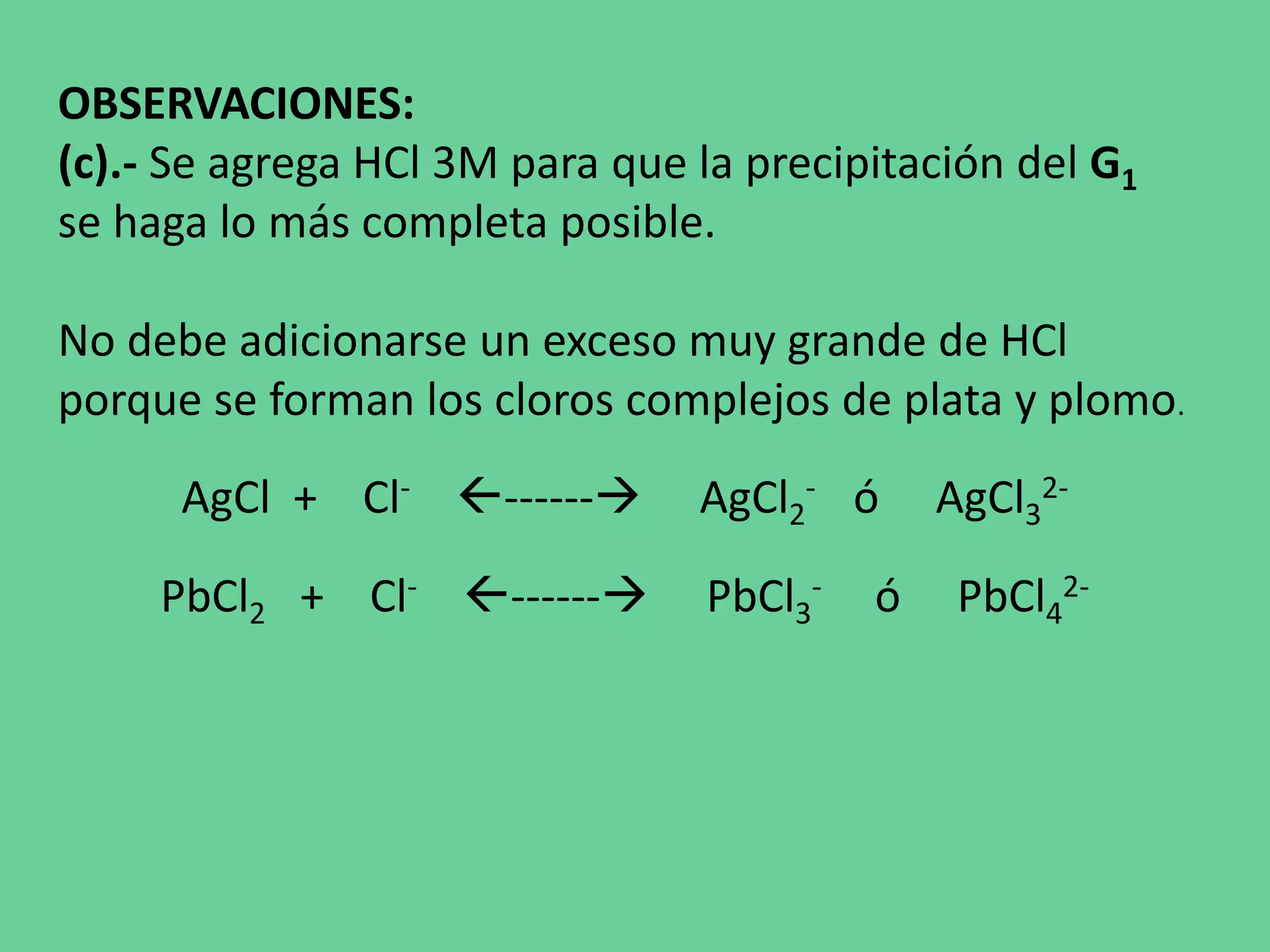
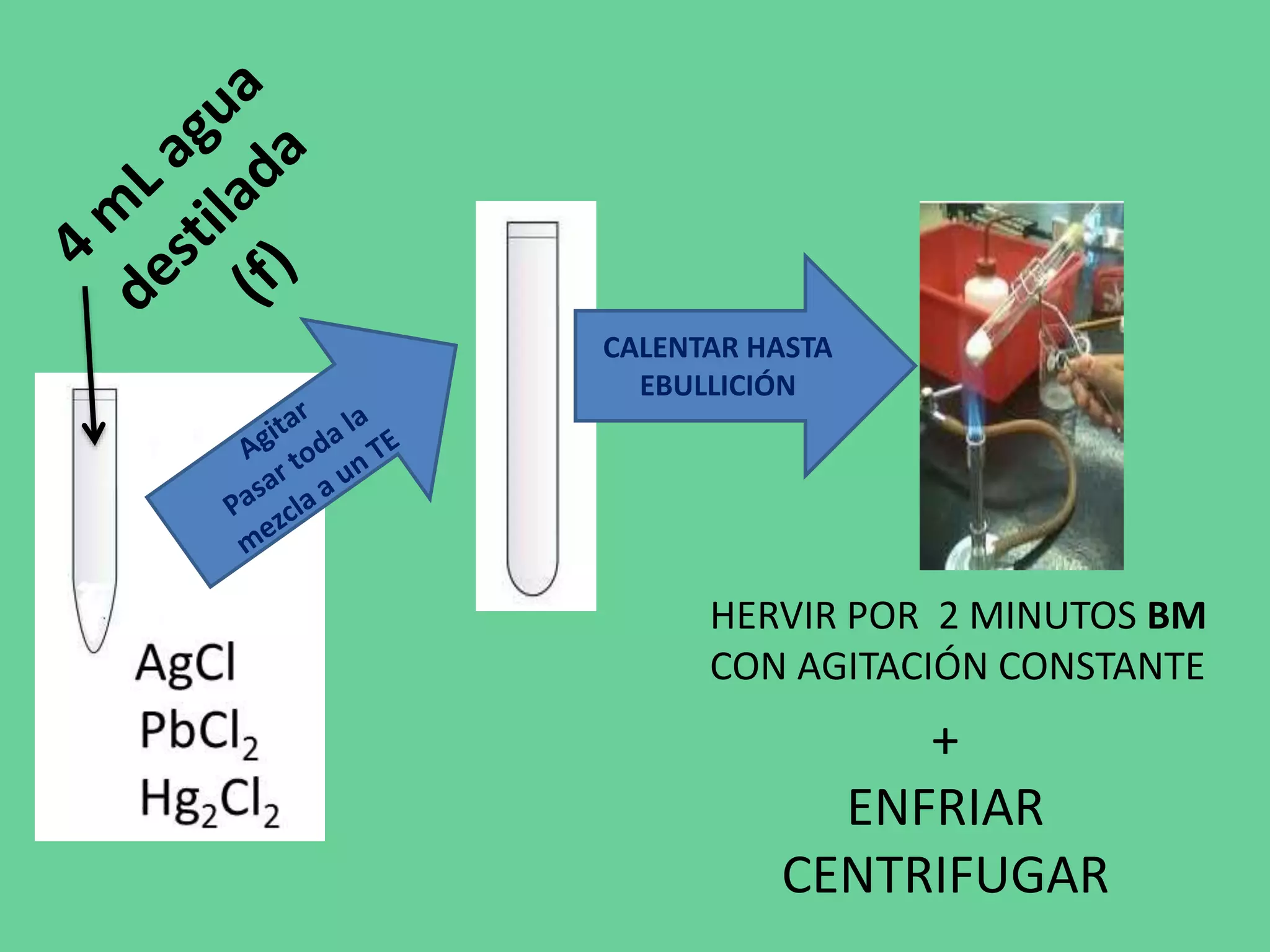
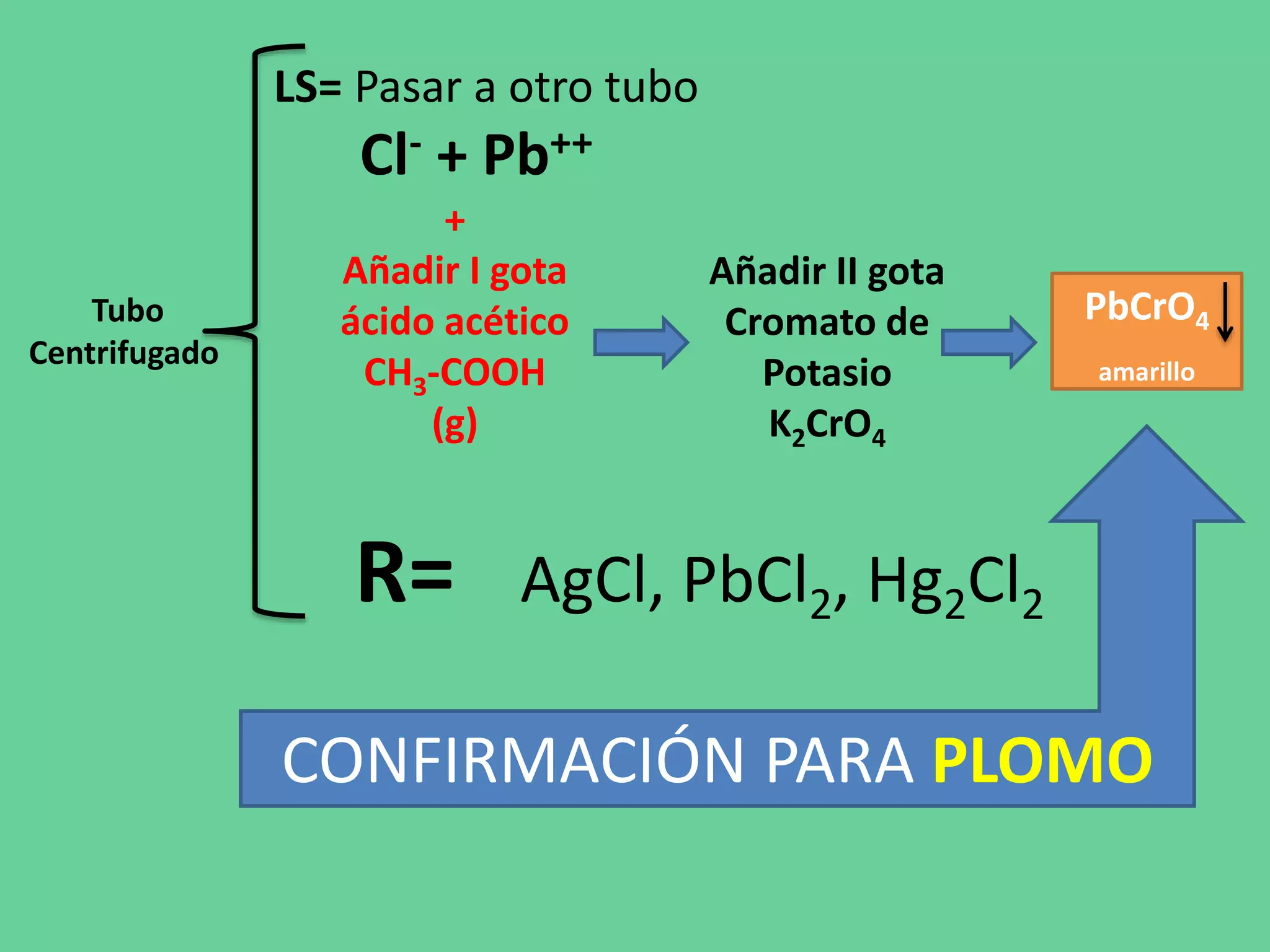
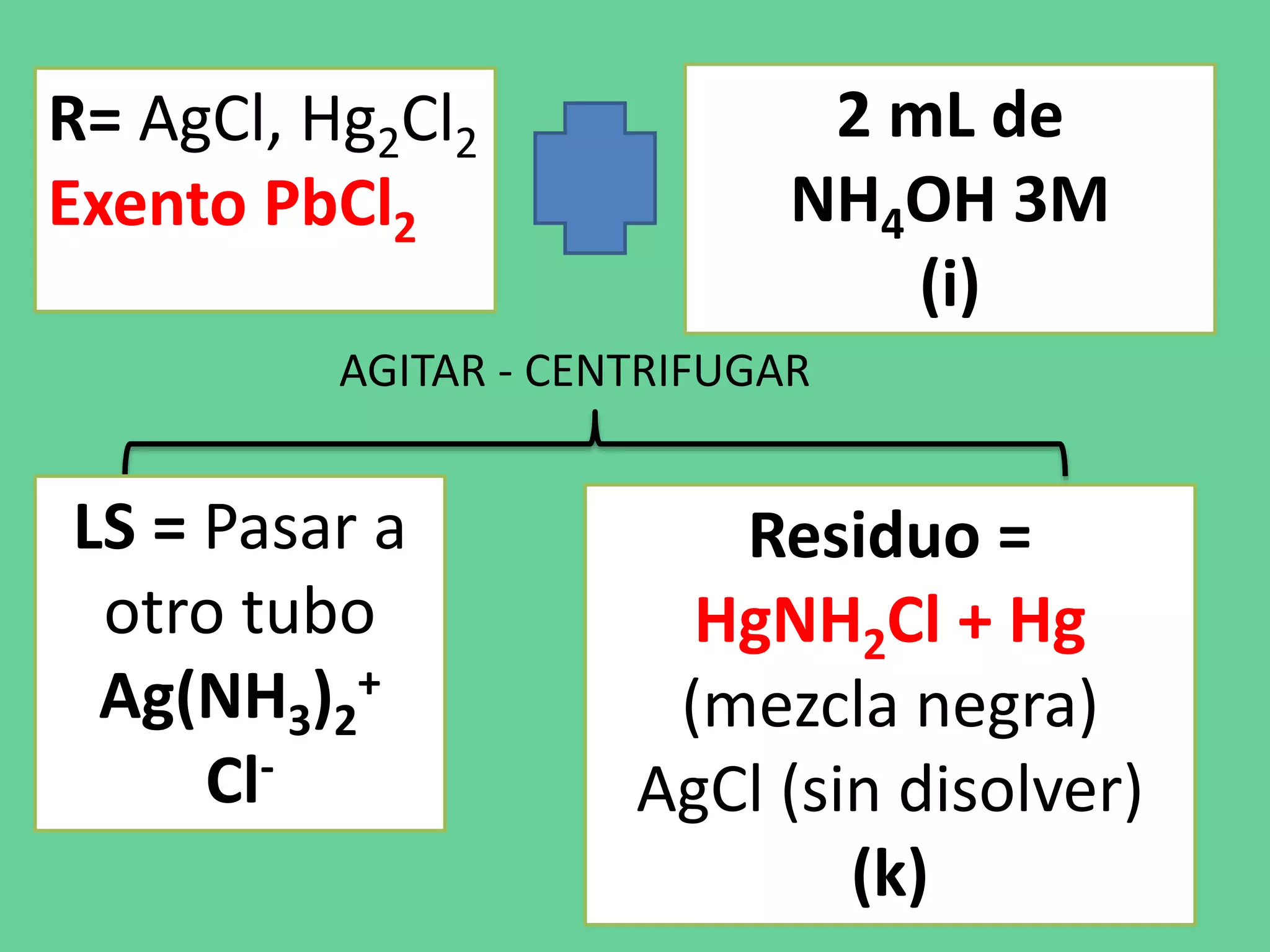
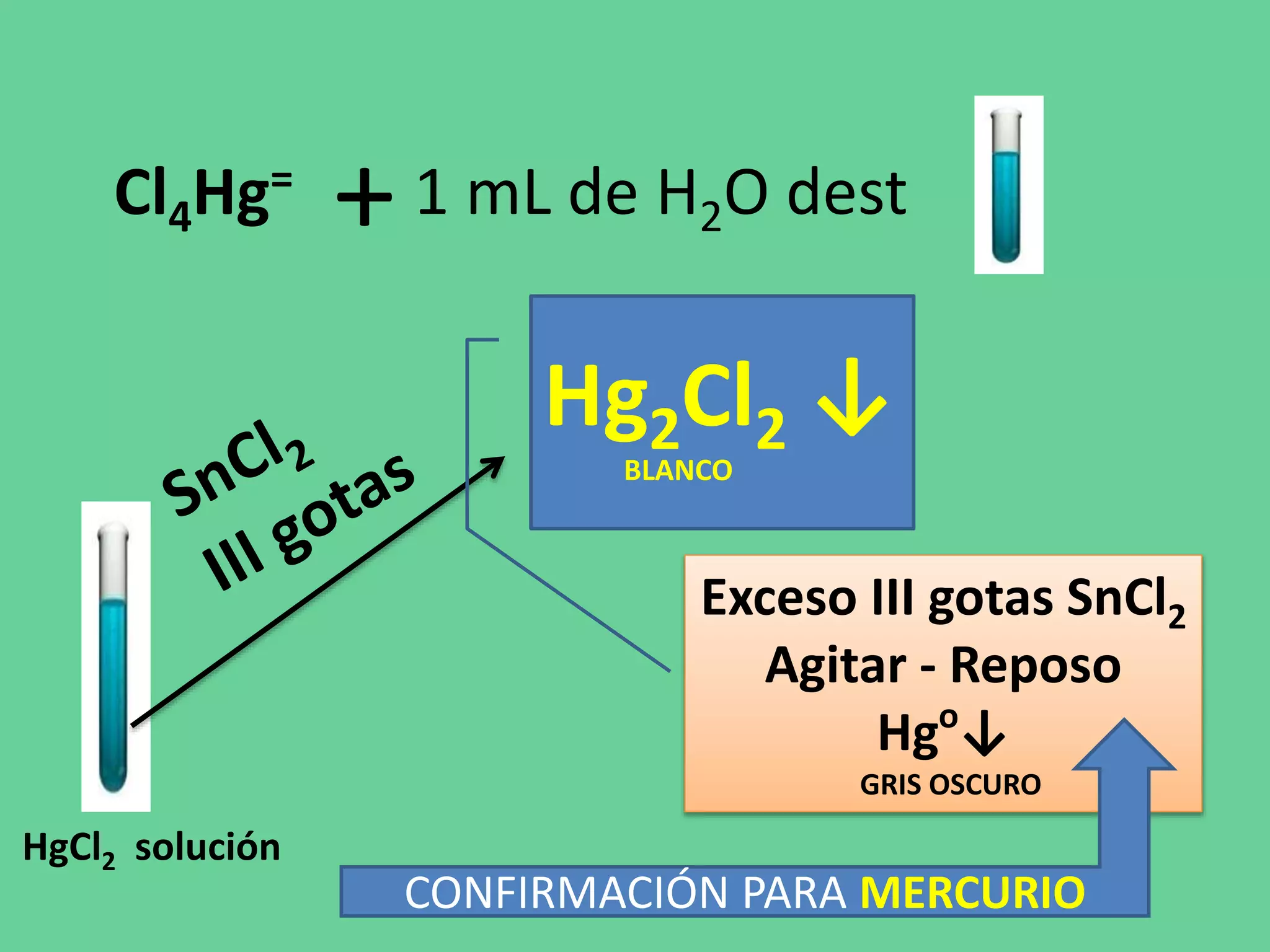
Este documento describe los pasos de un análisis químico cualitativo para identificar cationes del Grupo 1 (Ag+, Pb2+, Hg2+). Se agregan reactivos para precipitar los cationes y formar cloruros. Luego, se usa ácido acético, cromato de potasio y sulfato de amonio para confirmar la presencia de plata, plomo y mercurio, respectivamente. El proceso implica varias etapas de lavado, calentamiento y adición de reactivos para separar e identificar cada catión.