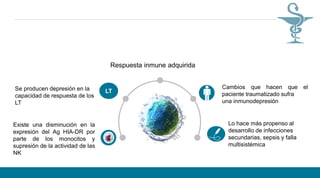
La respuesta inmune a la malaria es compleja dado que el parásito Plasmodium tiene múltiples formas en su ciclo de vida y infecta diferentes células del huésped humano y del mosquito vector. A pesar de la participación de varias células y moléculas del sistema inmune como macrófagos, células NK, linfocitos T y B, y el complemento, la inmunidad adquirida en humanos se desarrolla lentamente y solo ocurre de forma parcial luego de repetidas reinfecciones. La malaria sigue si









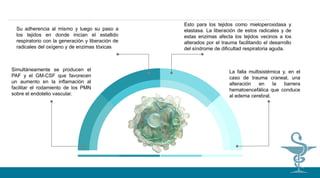




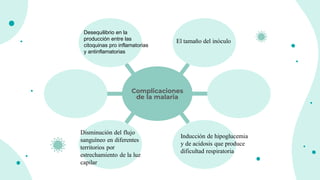
![4) Disminución del flujo sanguíneo en diferentes territorios por estrechamiento de la luz
capilar ocasionado por la adherencia de eritrocitos parasitados al endotelio.
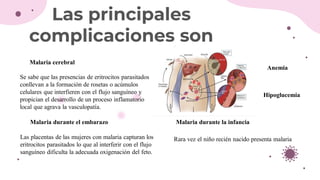
Las principales complicaciones son:
Malaria cerebral. - La fisiopatología de la malaria cerebral no está totalmente esclarecida.
Se sabe que las presencias de eritrocitos parasitados conllevan a la formación de rosetas
o acúmulos celulares que interfieren con el flujo sanguíneo y propician el desarrollo de
un proceso inflamatorio local que agrava la vasculopatía.
Malaria durante el embarazo. - Las placentas de las mujeres con malaria capturan los
eritrocitos parasitados lo que al interferir con el flujo sanguíneo dificulta la adecuada
oxigenación del feto. Esta vasculopatía que se produce en la placenta da lugar al
nacimiento de niños con poco peso y ocasiona que cada año mueran de 100.000 a 200.000
de ellos.
Malaria durante la infancia. - Rara vez el niño recién nacido presenta malaria. Si la madre
la sufre durante el embarazo, la placenta es una barrera muy eficiente que ataja los
parásitos. El paso en la leche de Acs, IgG y de citoquinas lo protegen de los parásitos que
le puedan ser inoculados por picaduras de mosquitos. El calostro suministra LsT
activados contra el plasmodio. Adicionalmente la leche materna carece de ácido
paraminobenzoico esencial para el desarrollo del parásito. Pasados los primeros meses,
este ácido empieza a llegar en la alimentación del niño y los factores humorales y
celulares protectores recibidos de la madre, disminuyen, haciendo que el niño se haga
susceptible a adquirir la infección.
Anemia. - por lisis de eritrocitos parasitados.
Durante la fase de reproducción en el torrente circulatorio, el parásito consume grandes
cantidades de glucosa con lo cual se genera hipoglucemia que puede ser tan fuerte que
ocasione coma y convulsiones.
Vacunas
Una vacuna sintética dirigida contra los esporozoítos, se basa en la producción en el laboratorio
de la molécula más inmunogénica del esporozoíto, ha demostrado una capacidad protectora
moderada. La molécula más inmunogénica de los esporozoítos de P. falciparum es el péptido
Asn-Ala-Asn-Pro, que se repite unas 40 veces a lo largo del esporozoíto.
BIBLIOGRAFÍA:
Rojas, W; Cano, L; Anaya, J;Aristizábal; B; Gómez, L; Lopera, D. Inmunología de Rojas.
Inmunidad contra la Malaria. [citado el 28/06/2020]. CIB: corporación para investigaciones
biológicas. Medellín, Colombia. 2015. Pg.: 318-324.](https://image.slidesharecdn.com/infodelasexpos-200823222135/85/INFORMACION-DE-INMUNOLOGIA-27-320.jpg)



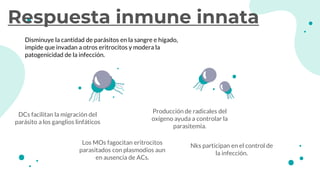

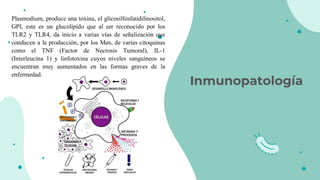






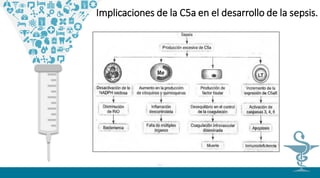
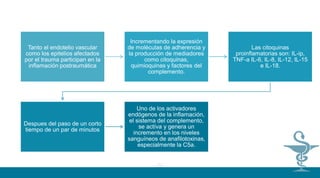
![Como moléculas proinflamatorias han sido descritas el factor de Necrosis Tumoral alfa, las
Interleucinas1,6,8, 12 y el Interferón gamma, Factor activador de plaquetas (FAP),
tromboxanos, prostacilina y otros derivados del ácido araquidónico.Por el contrario las
interleucinas,10,4,3 y las lipoproteínas ligadoras de lipopolisacaridos se consideran
moléculas antiinflamatorias entre otras. El factor de Necrosis Tumoral alfa es un producto de
los macrófagos, que funciona como un punto inicial para la generación de otros mediadores
inflamatorios, estimula en forma autócrina a los macrófagos para la liberación de Ínterleucina
1 beta, IL-6, FAP, metabolitos del ácido araquidónico y factores de crecimiento (5) Estimula
además células endoteliales para la liberación de factor quimiotáctico para neutrófilos.7 El
modelo de explicación clásico de la producción de esta sustancia fue desarrollado a partir del
estudio de la sepsis provocada por bacterias gram negativas, donde la molécula de la
membrana celular LPS una vez liberada se une en el suero a la proteína de unión al
lipopolisacararido (LPB) formando un complejo LPSLPB, que es reconocido por el receptor
CD14 de los macrófagos, formando un nuevo complejo, que a su vez es trasportado y activa
una nueva molécula llamada TLR2 que induce una cascada de señales que llevan finalmente
a la activación y producción de Factor de Necrosis Tumoral alfa.8,9 Este proceso describe
los fenómenos moleculares de la fase que clínicamente hemos mencionado como respuesta
proinflamatoria (4).
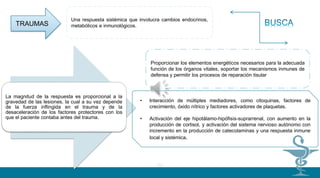
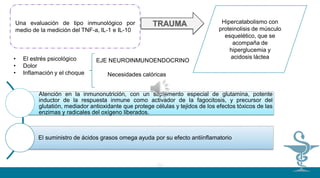
TRATAMIENDO
Después del tratamiento inicial del paciente traumatizado y antes de cualquier procedimiento
quirúrgico, si las condiciones vitales lo permiten y se dispone de las facilidades necesarias,
debe hacerse una evaluación de tipo inmunológico por medio de la medición del TNF-a, IL-
1 e IL-10, con el fin de evitar proceder a intervenciones quirúrgicas antes de que los
resultados muestren una estabilización del proceso inflamatorio. El trauma genera un
hipercatabolismo con proteinolisis de músculo esquelético, que se acompaña de
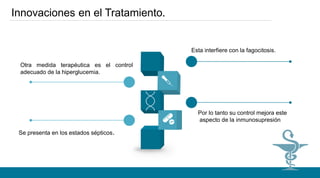
hiperglucemia y acidosis láctea que interfieren con la fagocitosis. El estrés psicológico, el
dolor, la inflamación y el choque estimulan el eje neuroinmunoendocrino lo que a su vez
genera un aumento en las necesidades calóricas. Es por lo tanto necesario poner especial
atención en la inmunonutrición, con un suplemento especial de glutamina, aminoácido
esencial, potente inductor de la respuesta inmune como activador que es de la fagocitosis, y
precursor del glutatión, mediador antioxidante que protege células y tejidos de los efectos
tóxicos de las enzimas y radicales del oxígeno liberados por el trauma (2).
BIBLIOGRAFÍA
1. Bruno L. Inmunologia de Rojas. Vol. 53, Journal of Chemical Information and
Modeling. 2019. 471 p.
2. Oscar Díaz Pineda, Ana Josefa Ramos Rivera, Sepsis y respuesta inmune, Med hond
2003 [28-07-2020], disponible en http://www.bvs.hn/RMH/pdf/2003/pdf/Vol71-2-
2003-7.pdf](https://image.slidesharecdn.com/infodelasexpos-200823222135/85/INFORMACION-DE-INMUNOLOGIA-50-320.jpg)


