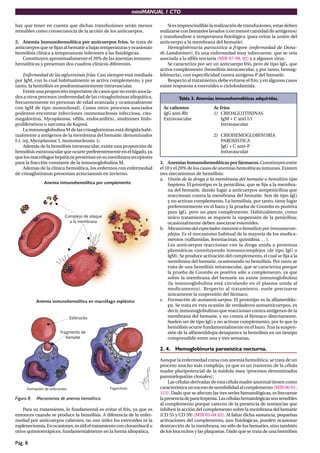
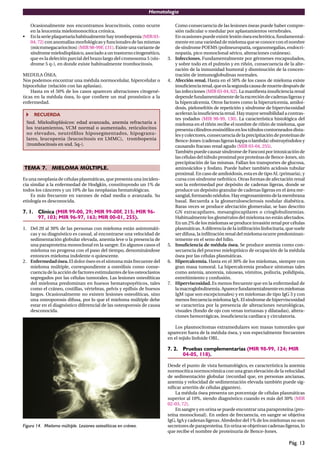
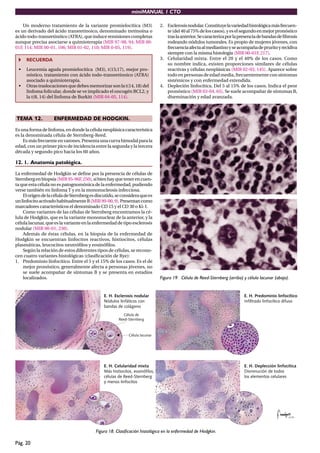
Este documento presenta un resumen de hematología. Contiene 14 temas que cubren diversos tipos de anemias (hemolíticas, megaloblásticas, ferropénica), síndromes mielodisplásicos, mieloma múltiple, poliglobulias, síndromes mieloproliferativos crónicos, leucemia linfática crónica, leucemias agudas, enfermedad de Hodgkin y alteraciones plaquetarias y de la coagulación sanguínea. Explica la fisiología del eritrocito y