El documento describe los conceptos básicos del equilibrio ácido-base, incluyendo el pH, amortiguadores, y mecanismos de compensación respiratoria y renal. Explica los trastornos ácido-base como acidosis y alcalosis metabólicas y respiratorias, sus causas, mecanismos fisiopatológicos, y alteraciones clínicas asociadas.


![3
El ph!
Rango fisiológico:
H + 40 +/-4 nEq/l
pH 7.35-7.45
Carga ácida diaria:
Protones H+
Normal funcionamiento de
los mecanismos reguladores
Henderson : [H+]=24 x (CO2/HCO3)
• [H+] líquidos corporales es
40nEq/L
[H+] = pH
pH= -log10 [H+]
pH= -log10[40nEq/L]= 7.40
• Mecanismos para mantenimiento
del pH:
**Neutralización de H+ , LEC e LIC
(inmediato)
** compensación respiratoria, en
minutos u horas.
**compensación renal, lento, horas o
días
• Producción de Ácidos:
** Ácidos volátil (CO2), metabolismo
aeróbico celular
**Ácidos no volátiles:
***catabolismo de las proteínas (AA
azufrados: metionina, cisteina, cistina =
Acido sulfúrico)
***fosfolipidos (acido fosforico
(neutralizados en riñón))](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-3-320.jpg)





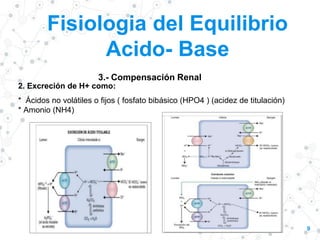



![“
13
Acidosis Metabólica
• Acumulación de ácidos fijos ( aumenta [H+] )
• Neutralización: LEC y LIC
• Compensación respiratoria : Hiperventilación ( disminuye PCO2 en plasma)
• Compensación renal: aumenta la excreción de H+ (acidez titulable y NH4) y
aumento en la síntesis y reabsorción de HCO3-) ) ------------aumenta HCO3-
en plasma
• Por cada [HCO3-] de 1 mEq/L (desde 25mEq/L), la pCO2 debe 0,85 –
1.2 mmHg (desde 40 mmHg).
• Mecanismos compensatorios: pCO2 esperado = (1,5 x HCO3-) + 8 +/-2](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-13-320.jpg)

![“
15
Alcalosis Metabólica
• pH HCO3- PCO2
• La concentración de cloro disminuye para compensar elevación del
bicarbonato
• Anión Gap aumenta en proporción a la severidad de la alcalosis.
• Por cada [HCO3-] de 1 mEq/L (desde 25mEq/L), la pCO2 debe
0,7 mmHg (desde 40 mmHg)
• Mecanismo compensatorio: pCO2 esperado= (0,7 x HCO3-) + 21 +/-2
• Perdida de ácidos fijos ( disminuye [H+]
• Neutralización: LEC y LIC
• Compensación respiratoria : Hipoventilación ( aumenta PCO2 en plasma)
• Compensación renal: disminución en la excreción de H+ (acidez titulable y
NH4) y aumento excreción de HCO3- … pero .. ALCALOSIS POR
CONTRACCIÓN (SRAA: secreta H+ y reabsorbe HCO3- ------------aumenta
HCO3- en plasma](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-15-320.jpg)


![“
18
Acidosis Respiratoria
• Por cada 1mmHg que se incremente la PaCO2 se produce un cambio en el pH de
0,003Uds ------------------------------- pH= 7,40 – [0,003 x (PaCO2 – 40)]– ACIDOSIS
RESPIARTORIA CRÓNICA
• Por cada 1mmHg que se incremente la PaCO2 se produce un cambio en el Ph de
0,008 Uds ------------------- pH= 7.40 – [0,008 x (PaCO2 – 40)] --- ACIDOSIS
RESPIRATORIA AGUDA
• Por cada pCO2 de 10mmmHg (desde 40mmHg), [HCO3-] 1
mEq/L (desde 25mEq/l) si es Aguda o 3mEq/L si es Crónica.](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-18-320.jpg)


![“
21
Alcalosis Respiratoria
• Por cada pCO2 de 10mmHg (desde los 40mmHg), la [HCO3-]
2 – 2,5 mEQ/L (desde los 25 mEq/L) si es Aguda y 5 mEq/L si es
crónica
• pH= 7,40 – [ 0,008 x (40 – pCO2)]---- ALCALOSIS RESPIRATORIA AGUDA
• pH= 7,40 – [ 0,003 x (40 – pCO2)]--- ALCALOSIS RESPIRATORIA CRÓNICA](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-21-320.jpg)


![24
Formulas
ALTERACIÓN FÓRMULA TRASTORNO AGREGADO
ÁCIDOSIS METABÓLICA PaCO2 experado= (1,5 x HCO3-
) +8 +/- 2
PaCO2 esperado = PaCO2
tomado (Ac Metabólica.)
PaCO2 tomado mayor que el
esperado (Ac. Resp)
PaCO2 tomado menor que el
esperado (Al. Resp)
ALCALOSIS METABÓLICA PaCO2 experado= (0,7 x HCO3-
) +21 +/-2
PaCO2 esperado= PaCO2
tomado (Al. Metabólica)
PaCO2 tomado mayor que el
esperado (Ac. Resp)
PaCO2 esperado es menor
que el esperado (Al. Resp)
Anión Gap= [Na+] – ([Cl-] + [HCO3-]): 12 +/- 2
Anión GapU: ( [Na+U] + [K+U]) – [Cl-U]: positivo o negativo](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-24-320.jpg)
![25
Formulas
ALTERACIÓN FÓRMULA TRASTORNO AGREGADO
ACIDOSIS RESPIRATORIA
AGUDA
CRÓNICA
1. EB = +/-2
2. pH= 7,40 – ([0.008 x PaCO2 –
40)]
1. EB esperado= (PaCO2 – 40) x
0,4
2. pH=7,40 – [0,003 x ( PaCO2 -
40)]
PH medido = pH calculado )Ac Resp Ag)
pH medido es mayor que el calculado
(Al. Met)
pH medido es menor que el calculado
(Ac Met)
EB tomado = EB esperado (Ac Resp)
EB tomado mayor que el EB esperado
(Al. Met)
EB tomado menor que el esperado (Ac.
Met)
pH medido = pH calculado (Ac Resp
Cron)
pH medido mayor que el calculado (Al
Met)
pH medido menor que el calculado (Ac
Met)](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-25-320.jpg)
![26
Formulas
ALTERACIÓN FÓRMULA TRASTORNO AGREGADO
ALCALOSIS RESPIRATORIA
AGUDA
CRÓNICA
EB= +/- 2
pH= 7,40 + [0,008 x ( 40 – PaCO2)
EB esperado= (PaCO2 – 40 ) x 0,4
pH= 7,40 + [0,003 x (40 – PaCO2)]
pH medido = pH calculado (Al. Resp
Ag)
pH medido mayor que el calculado (Al
metabólica)
pH medido menor que el calculado (Ac
metabolica)
EB medido = EB esperado
EB medido mayor que el esperado (Ac
Met)
EB medido menor que el esperado (Al.
Met)
pH medido = pH calculado (Al. Resp
Cron)
pH medido mayor que el esperado (Al.
Met)
pH medido menor que el esperado (Ac
Met)](https://image.slidesharecdn.com/phygases-220928020838-5f5fff04/85/pH-y-gases-pptx-26-320.jpg)







