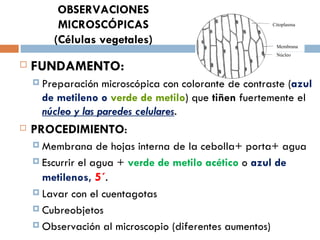
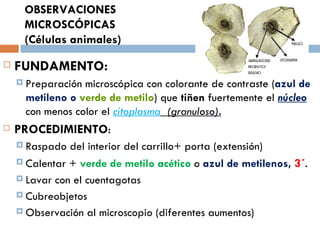
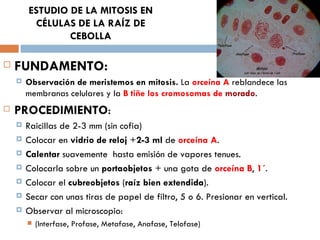
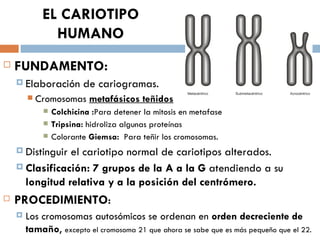
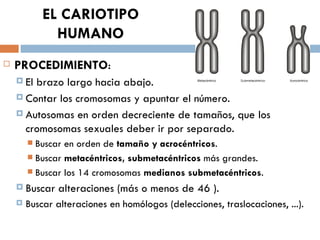
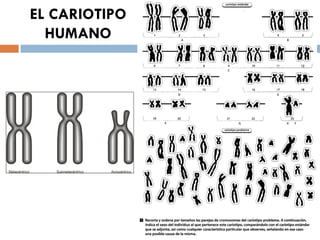
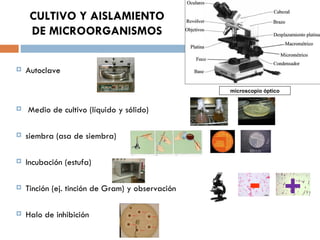
Este documento resume varias prácticas de laboratorio para la identificación de azúcares, almidón, digestión enzimática, observación microscópica de células, actividad enzimática, mitosis, cariotipo humano, cultivo de microorganismos y tinción de Gram. Las prácticas incluyen procedimientos detallados y sus fundamentos teóricos.