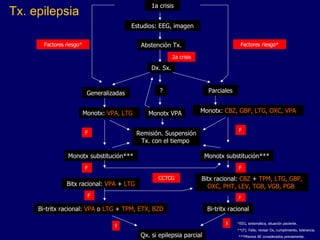
El documento trata sobre el tratamiento farmacológico de la epilepsia. Menciona algunas figuras históricas que padecieron epilepsia y clasifica los tipos de crisis epilépticas. Explica los mecanismos de acción de los medicamentos antiepilépticos y la historia del electroencefalograma.


























































































![Inactivación del canal de Na + por AE. Tradicionales. PHT. CBZ. VPA. Nuevos AE. FBM. LTG. OXC. TPM. ZNS. GBP. [ ] alta: PRM, PB, BZD. Enlentecen el retorno al estado de reposo. Indirectam. disminuyen la liberación otros neurotransmisores (glutamato más que GABA).](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-91-320.jpg)





















![Mecanismos acción. PB: GABAérgico postsináptico. GABA- A : Cl - . Fijación en sitio alostérico del receptor. Antiglutamatérgica postsináptico (mecanismo no precisado). Canales Ca ++ tipo T. A [ ] alta. PRM: Metabolizado a PB y Fenilmetilmelanamida FB notable efecto AE. FMM efecto AE leve. Potenciación PRM-PB.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-113-320.jpg)





![Mecanismos acción. ESM: Na + /K + ATPasa. [ ] alta. Alta hidrosolubilidad: integración memb. Canales Ca ++ tipo T en células talámicas de relevo (?) GABAérgico paradójico (disminuye tasa GABA). Acción en neurotransmisión dopaminérgica (?).](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-119-320.jpg)

















![PHT. SNC: Elimina fase tónica pero puede empeorar o alargar la clónica. No inhibe crisis clónicas inducidas por pentilenetetrazol. Toxicidad. Signos excitatorios. Niveles letales: rigidez decerebración. Mecanismo Acción: Enlentecimiento de la tasa de recuperación de la inactivación de canales Na + voltaje-dependientes. [ ] 5 a 10v mayor: aumentan respuesta a GABA, disminuyen actividad espontánea, toxicidad.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-137-320.jpg)


![PHT. Farmacocinética: T1/2: 6-24 hrs ([ ] 10 g/ml). Aumenta a [ ] más alta de manera no-lineal. x saturación de la hidroxilación o inhib. de ésta x metabolitos. Hidrosolubilidad limitada. Fosfenitoína: Pro-droga hidrosoluble. Conversión a PHT por fosfatasas hepáticas y eritrocitarias. T ½: 8-15’. Unión PP (albúmina): 95-99%. Desplaza a PHT de PP. Tx. crisis parciales y generalizadas: IV, IM.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-140-320.jpg)
![PHT. Farmacocinética. Llega a cerebro igual que a plasma. En LCR igual que la fracción libre en plasma. IM. Absorción lenta e impredecible. Se precipita en el sitio de inyección, por ello no utilizar esta vía. VO. Lenta, incompleta, variable, [ ] máx. 3-12hrs. Absorción lenta: evita fluctuación.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-141-320.jpg)




![PHT. Toxicidad. Endocrinológicas. Inhib. liberación vasopresina. Hiperglucemia y glucosuria. Inhib. secreción insulina. Osteomalacia, hipocalcemia, FA elevada. Alt. metab. vit. D, inhibe absorción intestinal Ca ++ . Aumenta metab. vit. K y disminuye [ ] prots. dependientes de vit K. Imp. en metab. Ca ++ en hueso. Por ello no siempre responden a admon. vit. D. Hipersensibilidad Exantema morbiliforme: 2-5%. Sx. Stevens-Johnson.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-146-320.jpg)



![PHT. [ ] plasmática: Tx 10-20 g/ml. >20: nistagmus. >30: ataxia. >40: letargo. Rango estrecho entre dosis Tx. y toxicidad.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-150-320.jpg)
![PHT. Interacciones. Medicamentos metab. por CYP 2C9/10: aumentan [ ] de PHT. Cloranfenicol, dicumarol, disulfiram, HAIN, cimetidina, algunas sulfas (sulfisoxazol), salicilatos. TBT (compite en unión PP). Disminuye PHT. CBZ. Por aumentar su metab. PHT disminuye la [ ] de CBZ. Teofilina disminuye DFH x aumentar su metab. y disminuir su absorción.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-151-320.jpg)







![PB. Farmacocinética: Absorción VO: completa, lenta. Pico [ ] en horas. Unión PP: 40-60%. Unión todos los tejidos. Incluyendo cerebro. Eliminación renal: 25%. pH dependiente. Metab. hepático: 75%. CYP 2C9 (el más imp.), 2C19 y 2E1. CYP 2C, 3A (anticonceptivos orales 3A4). Uridin-difosfato-glucuronosiltransferasa (UGT). Metab inactivo. T ½: 100hrs. Mayor en neonatos. Menor en niños.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-159-320.jpg)

![PB. [ ] plasmática: Dosis adulto 1mg/Kg: niveles 10 g/ml. 5-7 g/ml niños. Tx. crisis: 10-35 g/ml. Profilaxis crisis febriles: 15 g/ml. >30 g/ml: sedación, ataxia, nistagmus. >60 g/ml: intox. >30-40 g/ml: sólo si es tolerado y contribuye al control de crisis.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-161-320.jpg)
![PB. Interacciones. Inducción CYP por PB. Aumenta su [ ] hasta 40% con uso de VPA. Interacción con PHT. Usos: CCTCG y parciales. 1-5mg/Kg (60-250mg). Dosis doble los 1os 4d para alcanzar niveles Tx. Sedación. Niños 3-5mg/kg en 2 dosis divididas.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-162-320.jpg)
![Barbitúricos: MPB. N-metil-PB. N-demetilado en hígado a PB. Mayor actividad con uso Cr. por acúmulo de PB. Absorción VO incompleta. Doble dosis que PB. Guía: [ ] plasmática de PB. Resto igual a PB.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-163-320.jpg)
![Deoxibarbitúricos: PRM. Tx. parciales y tónico-clónicas. Estructura: Congénere de PB. Menos potente. Metab. activo: PB. Farmacocinética: VO: absorción rápida. [ ] máx: 3hrs. T ½: 5-15hrs. 2 metab. activos: PB y PEMA (fenil-etil-malonamida) PEMA: T ½: 16hrs. Unión PP: PRM y PEMA. PB: solo la mitad. PEMA y PB: 60%. Excreción renal sin cambios: 40%.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-164-320.jpg)
![PRM. Toxicidad: Sedación, vértigo, mareo, náusea, vómito, ataxia, diplopía, nistagmus, sensación de intox. Raro: exantema, leucopenia, trombocitopenia, Lupus-like, linfadenopatía, psicosis ag, A. megaloblástica, osteomalacia, hemorragia neonatal. [ ] plasmática: 1mg/Kg de PRM: 1 g/ml PRM: 2 g/ml PB. [ ] PEMA: intermedia. Guía por [ ] de PB. Toxic. >10 g/ml PRM.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-165-320.jpg)




![CBZ. Farmacocinética: Solubilidad acuosa limitada. VO: absorción errática y lenta. [ ] máx. 4-8hrs. Pede ser hasta 24hrs. Distribución en todos los tejidos. Unión PP: 75%. [ ] LCR igual a plasmática libre. Metab. hepático: conjugación e hidroxilación. CYP 3A4 (el más imp.). Induce CYP 2C y 3A, UGT (anticonceptivos orales 3A4). Induce su propio metab. Metab. activo: 10-11 epoxiCBZ. [ ] en plasma y cerebro del 50%. Eliminación urinaria. T ½: 10-20hrs. Disminuye a 9hrs con PHT o PB. Metabolito: T1/2 menor.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-170-320.jpg)


![CBZ. [ ] plasmática. [ ] Tx: 6-12 g/ml*. E. colat: [ ] >9 g/ml. Interacciones. PHT, VPA, PB: aumenta metab. CBZ. CYP 3A4. CBZ: aumenta metab. de PHT. Aumenta paso de PRM a PB. Disminuye la [ ] de VPA, LTG, TGB, TPM. Disminuye la [ ] de haloperidol. Su metab. se inhibe x propoxifeno, eritromicina, cimetidina, fluoxetina, HAIN. Rango estrecho entre dosis Tx. y toxicidad.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-173-320.jpg)
![CBZ. Usos. CPS, CPC, tónico-clónicas. No en ausencias o mioclónicas: exacerbación. Dolor neuropático. N. trigémino. N. glosofaríngeo. Dolor tabético. 70% respuesta sostenida. 5-20% suspenden por E. colat. [ ] plasmática para crisis: guía para tx. neuralgia. Tx. enf. bipolar*. Dosis: 10mg/kg. 200mg x2. Aumentar 600-1200mg/d adultos. Niños: 20-30mg/Kg dividida en 3-4 dosis. Evita fluctuaciones en [ ] plasmática. N. trigémino: 200mg/d. Aumentar hasta 1200mg/d. *También útiles VPA, LTG, GBP.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-174-320.jpg)



![Succinimidas: ESM. Mecanismo. Disminuye corriente T Ca ++ en neuronas talámicas ventrobasales en ratas y cobayos. Tálamo produce puntas “spike” de gran amplitud de 3Hz en ausencias. Farmacocinética. VO: absorción. [ ] máx. 3hrs. Unión a PP: pobre. [ ] LCR similar a plasma. Vol. distribución: 0.7L/kg. Metab. hepático: 75%. Enzs. microsomales. CYP ? Metabolito: hidroxietilo: 40%; inactivo; sufre glucoronización. Excreción urinaria sin cambios: 25 %. T1/2: 40-50hrs adultos, 30hrs niños.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-178-320.jpg)

![ESM. [ ] plasmática. Dosis 1mg/Kg: 2 g/ml. Tarda 4-6d en alcanzar sus niveles tx: 40-100 g/ml). Mayor a 160 puede tolerarse incluso sin toxic. Usos. Tx. ausencias. Dosis niños 3-6a : 250mg. Dosis adultos y niños >6a: 500mg. Aumentar 250mg c/s. Dosis dividida previene náusea y mareo. Dosis mantenimiento: 20mg/Kg/d. Cuidado si dosis >1500 en adultos ó 700-1000 en niños.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-180-320.jpg)



![VPA. Farmacocinética. VO: absorción rápida y completa. [ ] máx: 1-4hrs. Puede retrasarse x alimentos o presentación LP. Vol. distribución: 0.2L/kg. Unión PP: 90%. No linear. [ ] LCR igual a plasmática libre. Transportador dentro y fuera del LCR. Metab. hepático: 95%. UGT y -oxidación. CYP 2C9, 2C19 en menor proporción. Metab. activos: ác. 2-propil-2-pentenoido y ác. 2-propil-4-pentenoico. El primero: acumulación significativa en plasma y cerebro. Excreción renal sin cambios: 5%. T ½: 15hrs. Disminuye con otros AE.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-184-320.jpg)


![VPA. [ ] plasmática Tx: 30-100 g/ml. A partir de 30-50 g/ml: saturación de albúmina. Interacciones. Inhibe drogas metabolizadas por CYP2C9. DFH, PB. Aumenta niveles PB: 40% Inhibe UGT. Inhibe metab. de LTG y loracepam. Unión imp. a albúmina. Desplazamiento de DFH. CZP + VPA: status epilepticus de ausencia (raro).](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-187-320.jpg)


![Trimetadiona. Farmacocinética. VO: absorción rápida. [ ] máx: 0.5-2hrs. Unión PP: pobre. Metab. hepático enzs. microsomales. Dimetadiona: activo, excreción renal. T1/2: 6-13d.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-190-320.jpg)
![Trimetadiona. Toxicidad. Sedación, hemeralopsia (visión borrosa con la luz brillante, “deslumbrado”), mareo. Dermatitis exfoliativa, exantema. Discrasias sanguíneas, neutropenia moderada (20%), A. aplásica, pancitopenia. LEG, MG, linfadenopatía, hepatitis, nefrosis. [ ] plasmática. Dosis 1mg/Kg: 0.6 g/ml. Dimetadiona 12 g/ml. Se requieren semanas para alcanzar [ ] plasmática. [ ] Tx: 700 g/ml trimetadiona. Usos. Ausencias que no responden a otros fármacos. Por su toxic. Dosis adultos: 900-2400mg. Dosis niños: 20-40mg/Kg (300-900mg).](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-191-320.jpg)

![BZD. Mecanismos. Aumentan acción GABA en receptor GABA A (aumenta conducción Cl - ). Aumenta frecuencia pero no duración de la apertura de canales Cl - . [ ] alta: disminuye disparo de alta frecuencia sostenido Dosis usadas en status epilepticus.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-193-320.jpg)

![BZD. Farmacocinética. VO: absorción adecuada. [ ] máx: 1-4hrs. Liposolubles. Paso rápido a tejidos. DZP: redistribución rápida. T ½: 1 hr. Unión PP. DZP: 99%. CZP: 85%.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-195-320.jpg)

![BZD. Toxicidad. CZP E. colat. más frec: mareo, letargo. 50%. Incoordinación, ataxia: menos frec. Hipotonía, disartria, vértigo. Alt. conducta (niños): agresión, hiperactividad, irritabilidad, dif. [ ]. Anorexia o hiperfagia. Aumento secreción salival y bronquial. Aumento crisis. Status epilepticus por suspensión abrupta. DZP, LZP, CZP: depresión resp. y cardiaca. [ ] plasmática. Poco valor. CZP [ ] Tx. 5-70ng/ml. N desmetilDZP por metab. del CLP: 0.5-1.9 g/ml.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-197-320.jpg)
![BZD. Usos. CZP. Niños: ausencias, mioclónicas. Tolerancia 1-6m. Dosis inicial adulto: <1.5mg/d. Dosis inicial niño: 0.01-0.03mg/Kg/d. Dosis divididas: 2-3v/d disminuyen E. colat. Aumento niños c/3d: 0.25-0.5mg/d. Aumento adulto c/3d: 0.5-1mg. Dosis máx. adulto: 20mg/d. Dosis máx niño: 0.2mg/Kg/d. 0.05mg/Kg/d aumenta [ ] 25ng/ml.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-198-320.jpg)





![GBP. Farmacocinética. VO absorción. Sin metab. Excreción renal sin cambios. T1/2 7-8hrs. No afecta [ ] plasmática de CBZ, PHT, PB o VPA. Toxicidad. Somnolencia, mareo, ataxia, fatiga. Tolerancia en 2s. Usos. Parciales: 900-1800mg/d en 3 dosis divididas. Iniciar con 300mg y aumentar 300mg/d. Tx. adjunto. Un estudio doble-ciego: monotx. eficacia similar a CBZ*. Pacientes con insuf. hepática, alergias cutáneas, SIDA, porfiria, ancianos con fármacos concomitantes. Tx. profiláctico de migraña, dolor neuropático, trast. bipolar. *Chadwick et al. 1998.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-204-320.jpg)










![LEV. Farmacocinética. VO absorción rápida y completa. Pico de [ ] plasmática: 1hr. Sin unión a PP. <10%. Metab. por hidrólisis (24%). Metabolito inactivo: grupo acetamida. Sin alt. de CYP. Sin interacciones con AE, anticonceptivos o anticoagulantes. Farmacocinética. Lineal: entre 500-5000mg en adultos, 20-60mg/kg/d en niños. Predecible: no requiere medir niveles plasmáticos. Estado estable: 2d. T ½: 7 hrs. Excreción renal 95%. 66% sin cambios. Ajustar si dep. Cr <80ml/min. Aumentar después de diálisis. No interacción con anticonceptivos orales, digoxina o warfarina.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-215-320.jpg)



























![AE Anexos. Bromuros. Antiguos. Combinación de sales de Na + , K + y amonio. Reemplazan a iones Cl - intracel. por su menor tamaño. [ ] Tx: 10-15mEq/L. T ½: 12d. Excreción renal exclusiva. Alta toxicidad. Usos. Eficaces en crisis generalizadas. De los pocos utilizables en porfiria intermitente.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-243-320.jpg)






![Farmacocinética: distribución. [ ] libre. No unida a pp. Puede ser distribuida. Unión a proteínas plasmáticas. Unida a pp. Evita su distribución. Modificada en: insuf. renal y hepática, embarazo, anciano. Competencia por unión a pp: interacción.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-250-320.jpg)

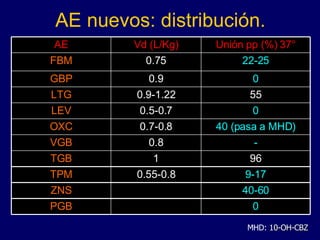






![Interacciones. Con otros AE. Inductores enzs. (CBZ, PHT, PB, PRM). Disminuyen la [ ]. Inhibidores enzs. (VPA, FBM). Aumentan la [ ]. Ej. LTG con VPA. Interacciones de AE 2a generación: poco estudiados. En general menos efecto sobre P450: menos interacciones. Gran variabilidad individual. Afectados por inductores enzimáticos: CBZ, PHT, VPA, PB, PRM, LTG, OXC, FBM, TGB, TPM, ZNS.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-259-320.jpg)







![Farmacocinética: excreción. T ½. Tiempo para eliminar el 50% de la [ ] después de la absorción. 2 T ½: ¾ de la molécula se elimina. 4 T ½: 15/16.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-267-320.jpg)
![Farmacocinética: niveles plasmáticos. Medición de niveles plasmáticos. Existe una relación constante entre las [ ] plasmática y tisular. Sin embargo [ ] plasmática no refleja la [ ] libre. Para nuevos AE en laboratorios especializados. Indicaciones de solicitud: Inicio del Tx. Post. a ajuste de dosis. Falla Tx. Cinética no lineal. PHT . Sospecha de no cumplimiento por el paciente. Sospecha de E. colat. dosis-dependientes. No siempre correlaciona con los niveles séricos. Politx. Medición de interacciones de acuerdo a niveles plasmáticos. Clínicam. bien + niveles inadecuados: no requiere ajuste. E. colat. + niveles adecuados: requiere ajuste.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-268-320.jpg)










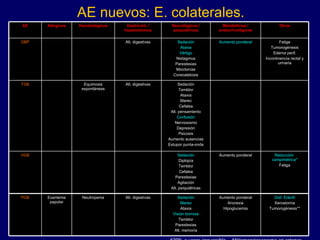













































![Decisión: Tx. 1a intención. Privilegiar monotx. Iniciar a dosis bajas. Progresar lento. Intervalos apropiados. Monitorizar [ ] plasmática. Reducir lento. Ventajas: menor interacción, E. colat. y costo.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-325-320.jpg)








![Seguimiento general. Causa más frec. de falla del AE: incumplimiento. Monitorizar [ ] plasmática*. Calendario de crisis. Menor # de AE a menor dosis posible. Antes de cambiar de AE, alcanzar dosis máxima tolerada. Prudente introducción (nuevo) y retiro (antiguo) de AE. Si politx. imp: disminuir a 2-3 AE. Hospitalizar de ser necesario. No dudar cambiar AE si efectos colat. imp. para el paciente aún si Tx. eficaz. Monitorizar. EF. BH con recuento plaquetario**. PFHs*. EEG*. Neuroimagen***. *Sin embargo es inútil multiplicar los niveles plasmáticos y EEG innecesarios. **Al menos 1v/a. Con mayor frecuencia si intolerancia o adaptación del Tx. ***Cuando se considere necesario.](https://image.slidesharecdn.com/tx-epilepsia-1207543949737100-8/85/Tx-Epilepsia-334-320.jpg)