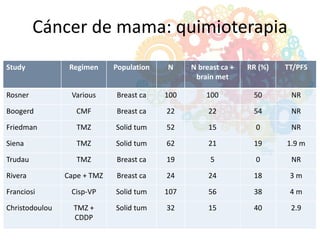
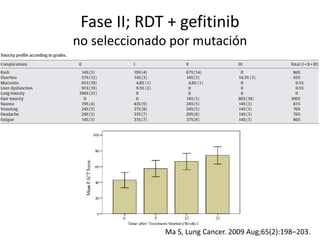
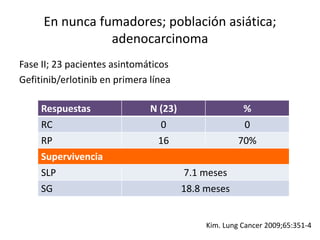
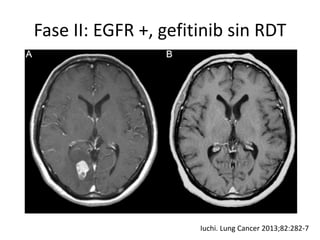
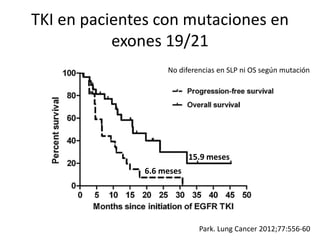
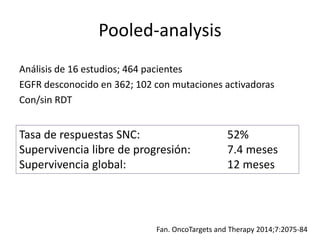
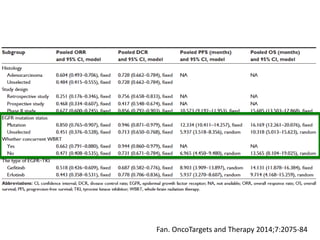
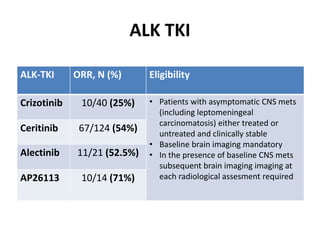
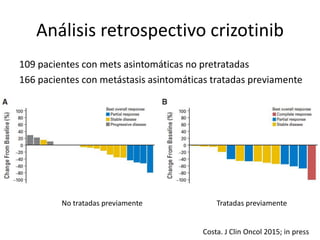
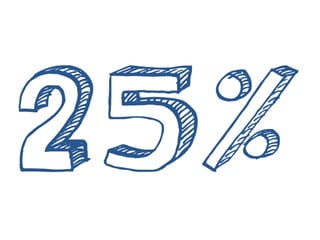Este documento resume la incidencia, pronóstico y tratamiento de las metástasis cerebrales en diferentes tipos de cáncer. La incidencia es mayor en cáncer de pulmón (20-40%), melanoma (10-50%) y cáncer renal (7-10%). El pronóstico depende de factores como la edad, el estado funcional y la presencia de metástasis extracraneales. El tratamiento incluye corticoides, radioterapia, cirugía, quimioterapia y nuevos fármacos como TKIs, con bu