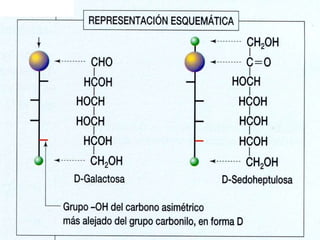
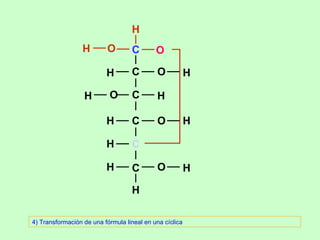
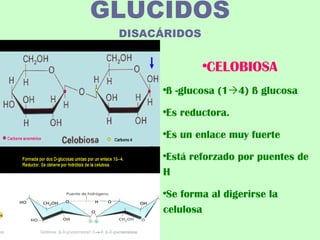
El documento proporciona información sobre los monosacáridos y sus propiedades. Explica que los monosacáridos son los glúcidos más simples, compuestos por cadenas de 3 a 7 átomos de carbono con grupos carbonilo y hidroxilo. Se describen diferentes tipos de monosacáridos como las triosas, tetrosas, pentosas y hexosas. También se explica la estereoisomería de los monosacáridos y cómo forman anillos cíclicos en disolución.