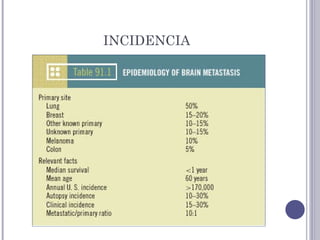
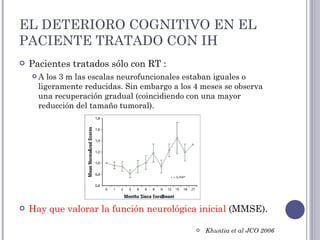
Este documento trata sobre la radioterapia holocraneal para el tratamiento de metástasis cerebrales. Describe las indicaciones, técnicas y efectos de la radioterapia holocraneal, incluyendo la profilaxis en cáncer de pulmón de células pequeñas. También discute factores pronósticos, cirugía, quimioterapia y toxicidad asociada al tratamiento.