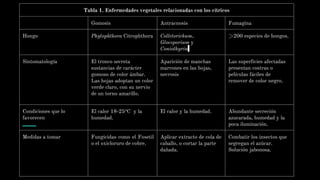
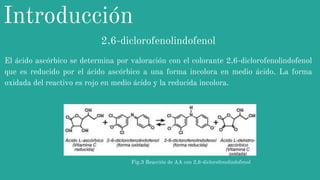
Este documento describe un experimento para determinar el contenido de vitamina C (ácido ascórbico) en jugo de naranja a través de valoración con 2,6-diclorofenolindofenol. Dos equipos realizaron el análisis y obtuvieron contenidos de 49.29 y 46.49 mg de ácido ascórbico por 100g de naranja respectivamente. El equipo 2 tuvo desviaciones estándar más cercanas a la media, indicando que llevó a cabo el método de mejor manera. El contenido encontrado está dentro del