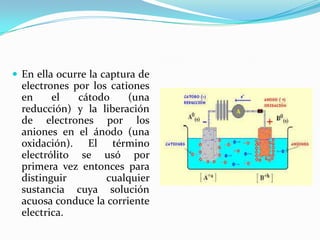
Este documento describe la historia del desarrollo de la comprensión de ácidos y bases desde la antigüedad hasta teorías modernas. Comenzó con clasificaciones basadas en las propiedades observadas por los sentidos. En la Edad Media, los alquimistas identificaron ácidos y bases con propiedades distintivas. Finalmente, teorías como las de Arrhenius, Bronsted-Lowry y Lewis proporcionaron definiciones fundamentales y explicaciones de las propiedades químicas de ácidos y bases.