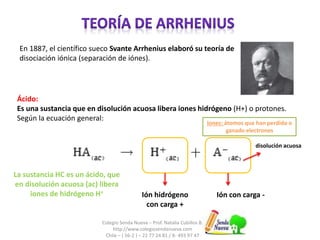
Este documento resume las teorías de Arrhenius y Brönsted-Lowry sobre ácidos y bases. Explica que según Arrhenius, los ácidos liberan iones hidrógeno y las bases liberan iones hidroxilo en disolución acuosa. Brönsted-Lowry proponen una definición más amplia donde los ácidos donan protones y las bases los aceptan, formando pares iónicos conjugados. También señala que el agua puede comportarse como ácido o base dependiendo de si acepta o dona protones.