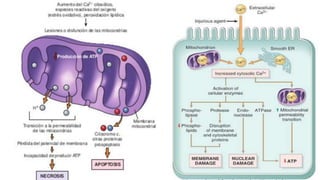
- La necrosis ocurre cuando hay lesiones graves en las membranas celulares que causan la digestión enzimática de la célula y la liberación de su contenido. La apoptosis es una muerte celular programada que mantiene la integridad de la membrana y elimina las células de forma fisiológica.