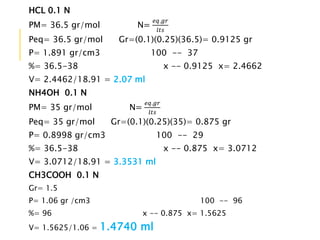
El documento describe los pasos para preparar soluciones de diferentes concentraciones requeridas para prácticas de laboratorio posteriores. Se explica cómo calcular las cantidades de reactivos necesarios para preparar soluciones molar, normal y porcentual, y la importancia de manipular correctamente los materiales y conocer la peligrosidad de los reactivos.