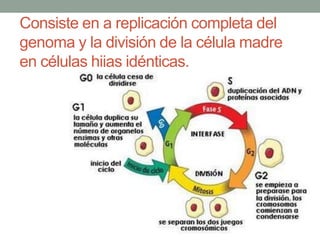
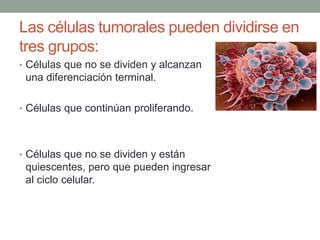
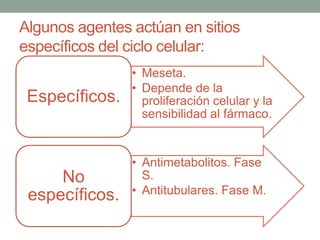
La quimioterapia consiste en el uso de fármacos para tratar el cáncer. Existen varios tipos de agentes quimioterapéuticos que actúan en diferentes puntos del ciclo celular como las fases S y M. La quimioterapia puede ser específica para ciertas fases o no específica, y se utilizan esquemas multiagentes para maximizar la eficacia del tratamiento. La determinación de la respuesta al tratamiento se realiza mediante criterios como RECIST.