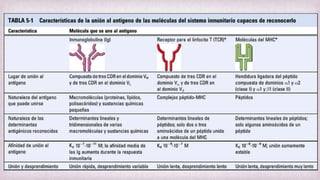
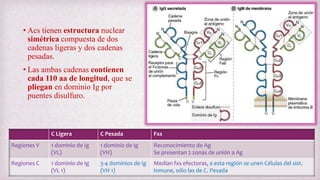
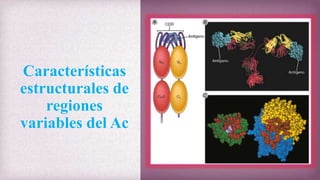
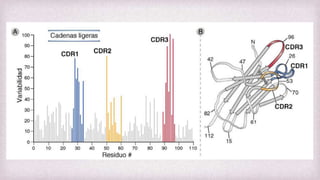
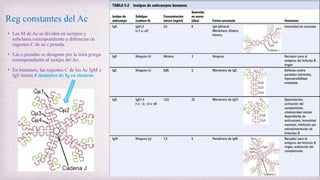
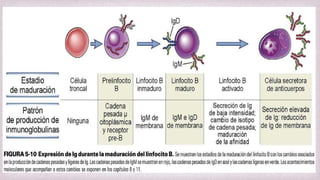
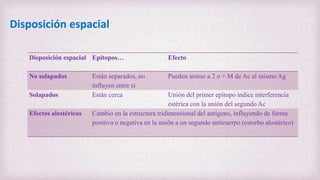
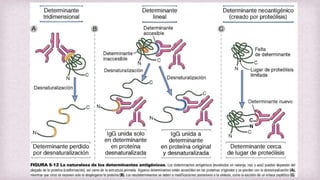
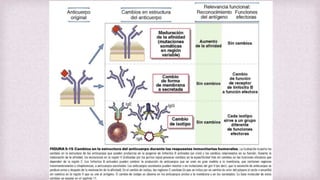
1) Los Ac son proteínas que se producen en respuesta a la exposición de antígenos y son los principales mediadores de la inmunidad humoral contra microbios. 2) Los Ac tienen estructura nuclear compuesta de dos cadenas ligeras y dos cadenas pesadas unidas por puentes disulfuro y enlaces covalentes. 3) Existen diferentes isotipos de cadenas pesadas que determinan las funciones efectivas de los Ac, como la activación del sistema del complemento u opsonización.