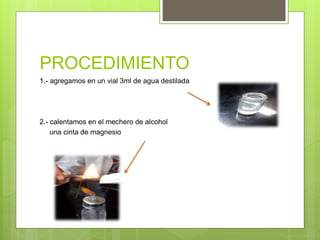
Este documento describe un experimento para observar cómo reaccionan los metales y no metales con el oxígeno. Se oxidaron muestras de magnesio, sodio, azufre y carbón, y se midió el pH de los productos. El magnesio y sodio produjeron bases, mientras que el azufre y carbón produjeron ácidos. Por lo tanto, los metales y no metales tienen un comportamiento diferente al reaccionar con el oxígeno.