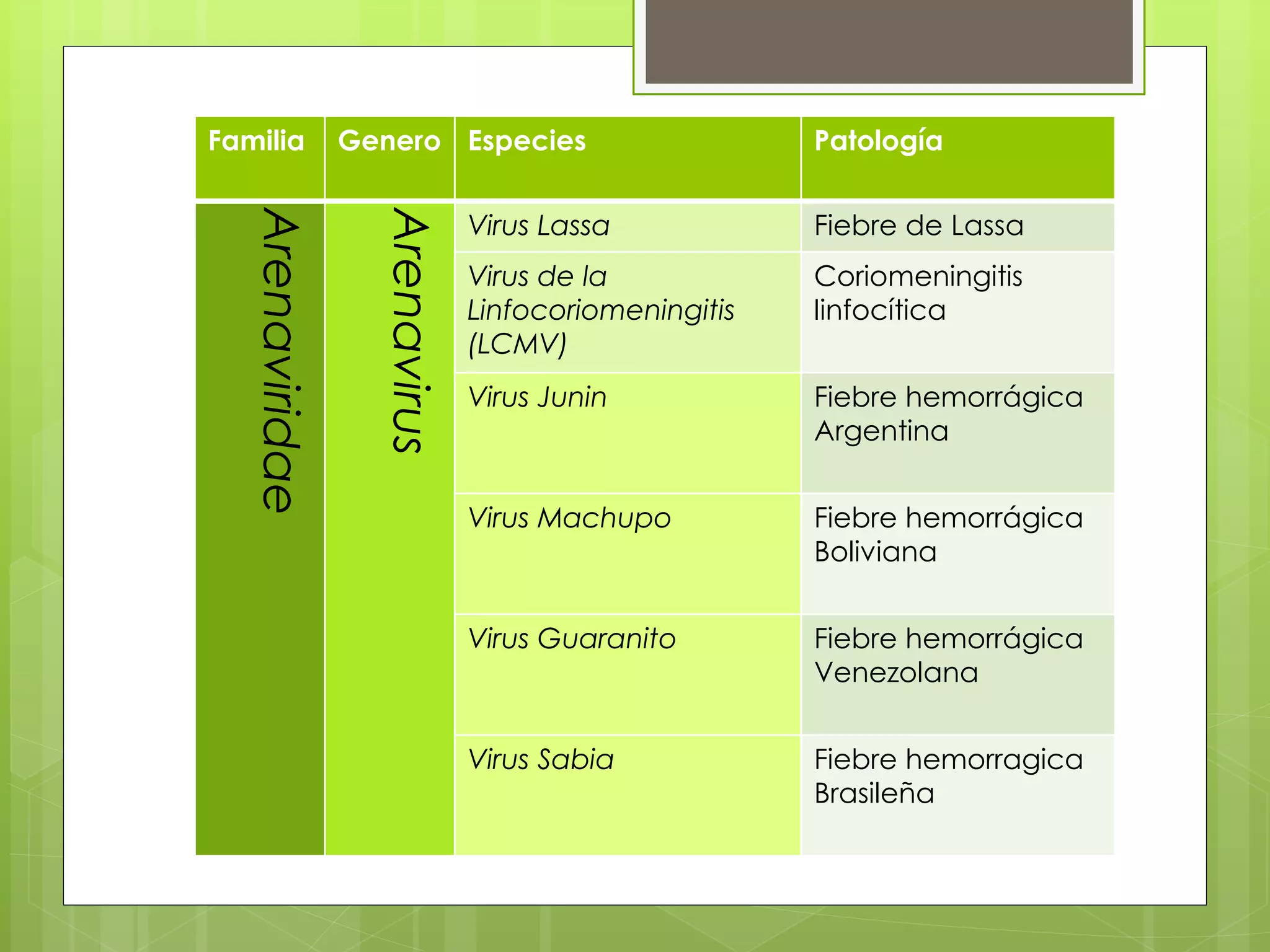
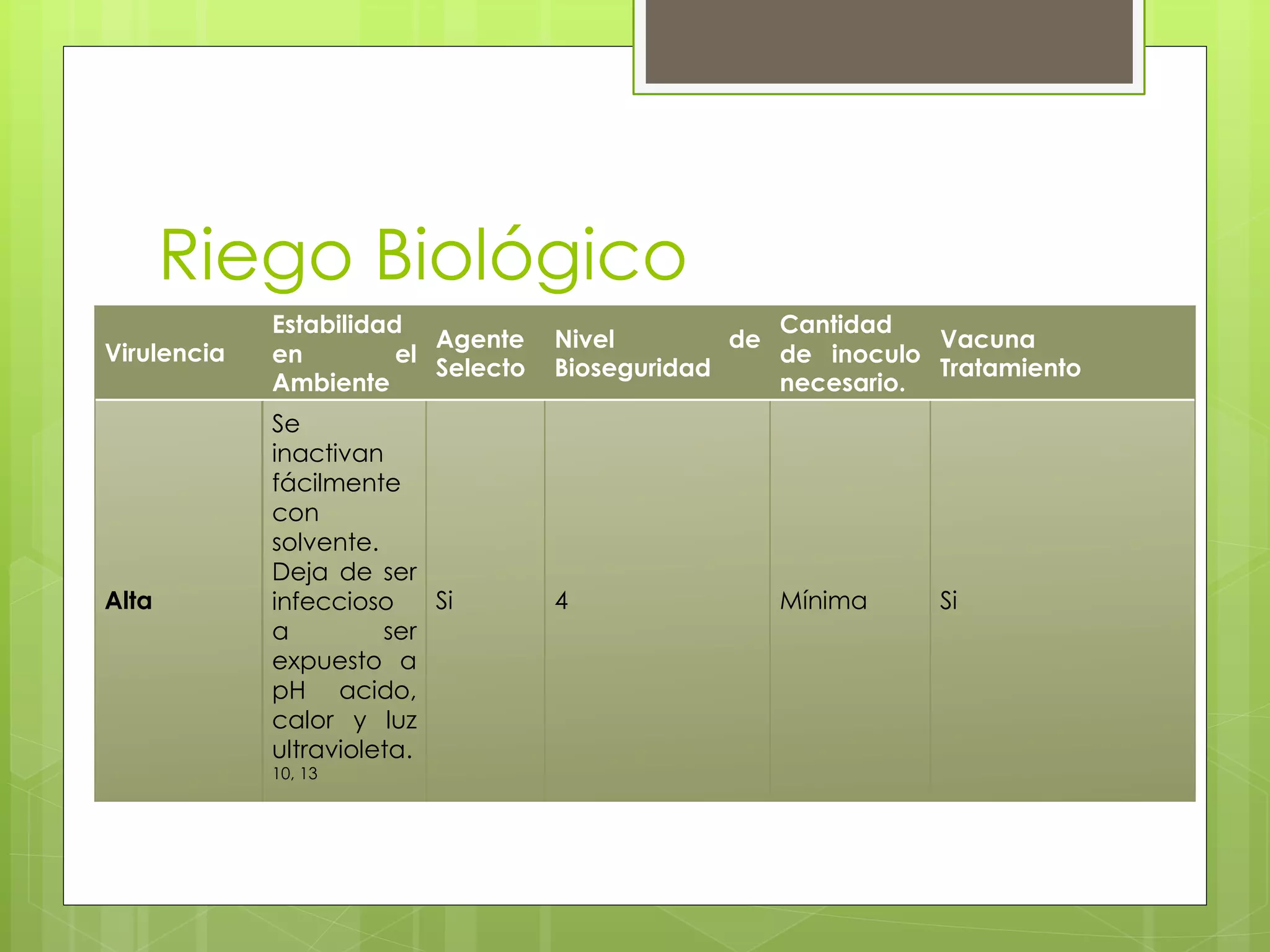
El documento describe la familia Arenaviridae, que incluye varios virus que causan fiebres hemorrágicas, como el virus Lassa, Junín, Machupo y Guanarito. Los arenavirus son virus esféricos de ARN de cadena simple, con envoltura, que se transmiten principalmente a través de roedores. Provocan enfermedades como la fiebre de Lassa, la fiebre hemorrágica argentina y la fiebre hemorrágica boliviana. No existe una vacuna para la mayoría de estas enfermedades,