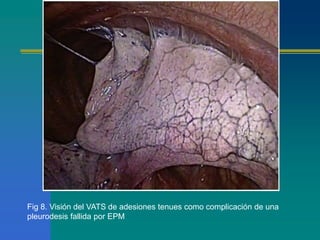
El documento trata sobre el manejo del derrame pleural maligno. Describe que el cáncer de pulmón y mama son los tumores más comunes que causan derrame pleural maligno, siendo responsables del 50-65% de los casos. Explica que la observación es una opción para pacientes asintomáticos con tipo de tumor conocido, mientras que la toracocentesis y colocación de tubo de drenaje pleural son procedimientos comunes para aliviar los síntomas en pacientes con derrame pleural maligno.