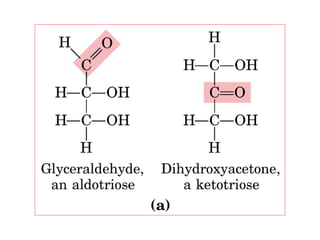
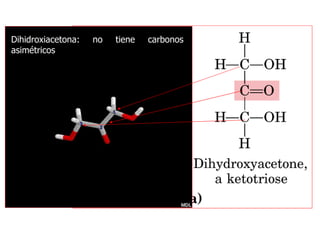
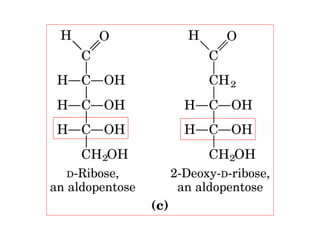
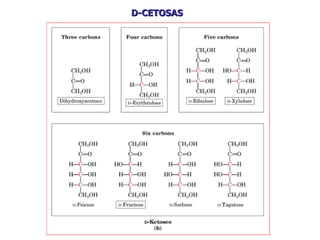
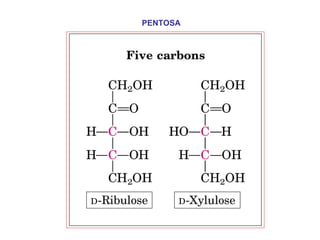
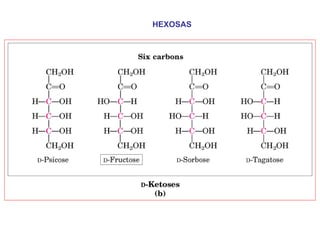
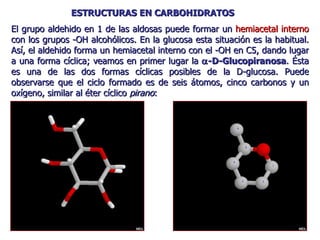
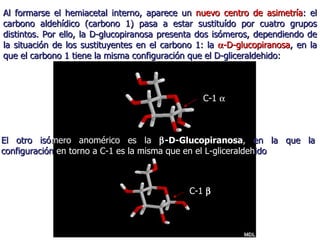
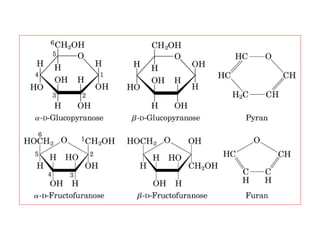
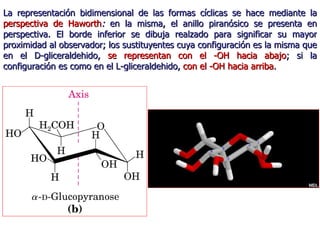
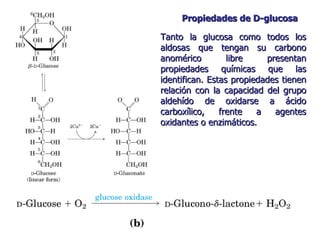
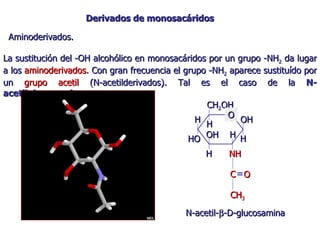
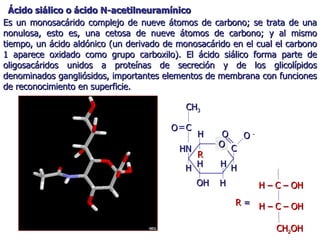
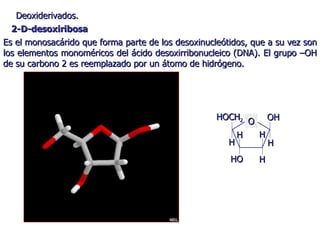
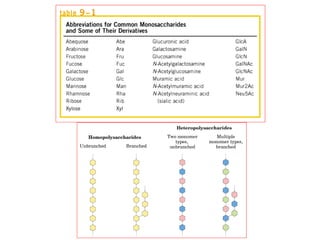
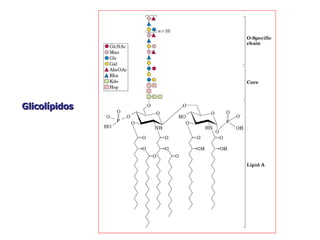
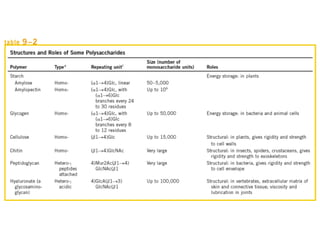
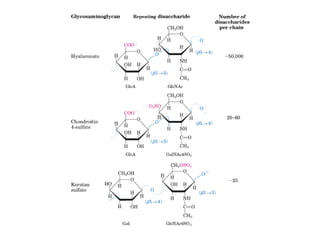
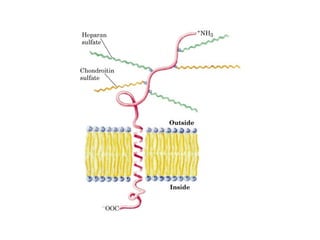
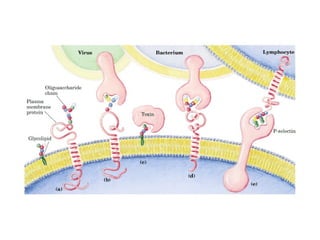
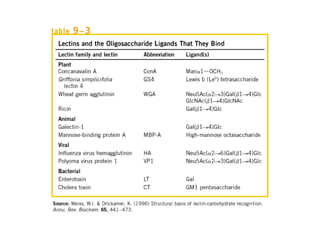
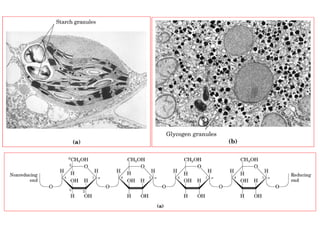
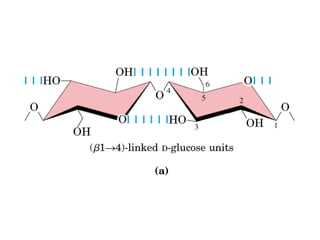
Los carbohidratos son biomoléculas abundantes que incluyen azúcares, almidón y polisacáridos. Pueden servir como combustible, estructuras de soporte o señales celulares. Existen monosacáridos como la glucosa, disacáridos formados por la unión de monosacáridos, y polisacáridos de cadenas largas. Algunos carbohidratos adoptan formas cíclicas y pueden presentar isomería anomérica. Los carbohidratos también se unen a proteínas y