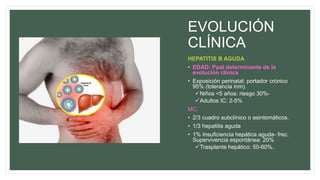
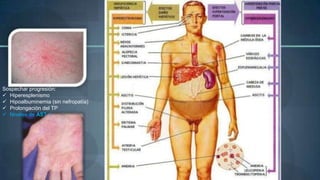
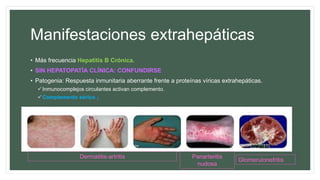
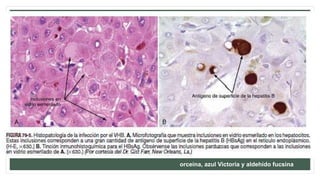
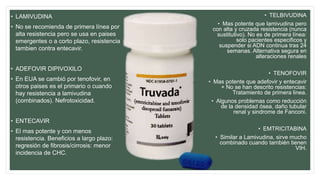
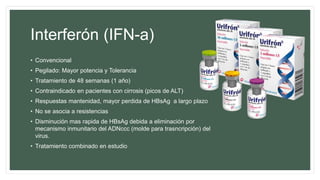
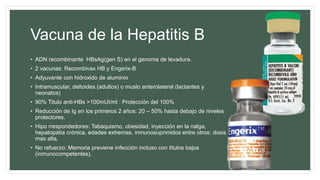
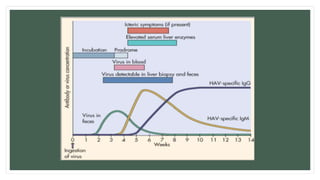
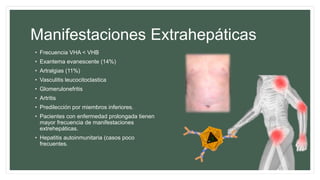
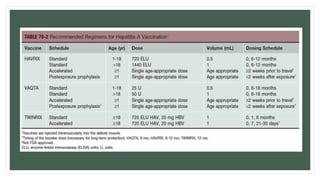
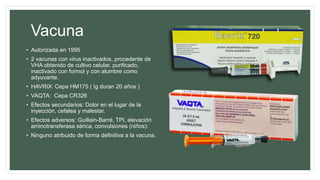
Este documento resume información sobre la hepatitis A, incluyendo: 1) Detalla el ciclo vital del virus de la hepatitis A, cómo se transmite y sus características; 2) Explica los síntomas clínicos típicos de la infección aguda por el virus de la hepatitis A y sus patrones de presentación; 3) Describe las medidas para prevenir la infección por el virus de la hepatitis A, incluyendo la vacunación.



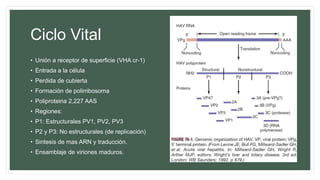














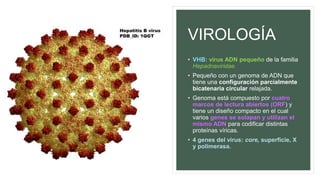
![VIROLOGÍA
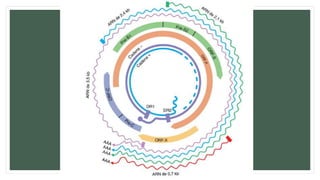
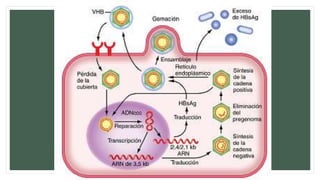
• El gen del core codifica la proteína de core de la nucleocápside, que es importante para el
ensamblaje del virus y la producción de HBeAg.
• El gen de superficie codifica las proteínas pre-S1, pre-S2 y S (que incluye una proteína de
superficie grande [L], intermedia [M] y pequeña [S]).
• El gen X codifica la proteína X, con propiedades transactivadoras y que puede tener
importancia en la carcinogenia hepática.
• El gen de la polimerasa cuenta con un ORF grande (unos 800 aminoácidos) y se solapa en
toda la longitud del ORF de superficie. Codifica una proteína grande con funciones esenciales
en el ensamblaje y la replicación del ADN (incluyendo las actividades de priming, de la ADN
polimerasa dependiente de ADN y ARN, y de la ARNasa H).](https://image.slidesharecdn.com/hepatitisviralfinalfinal-180622221700/85/Hepatitis-viral-A-y-B-30-320.jpg)