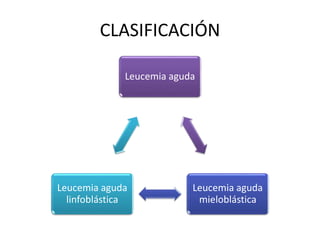
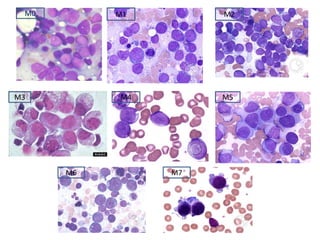
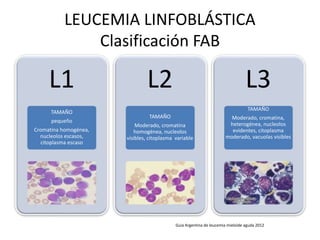
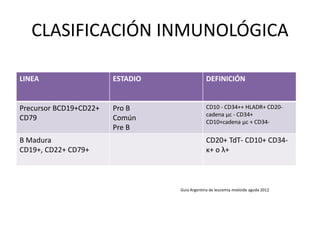
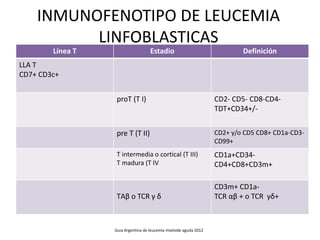
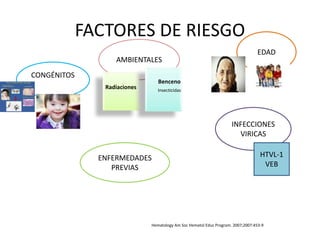
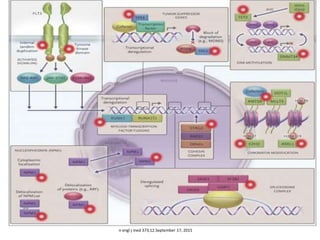
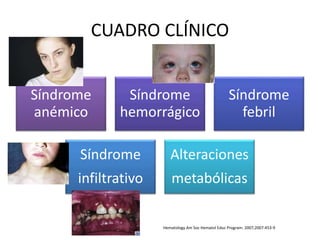
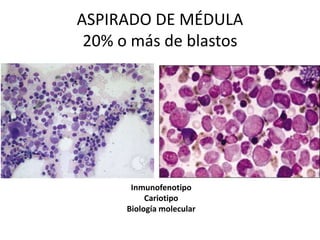
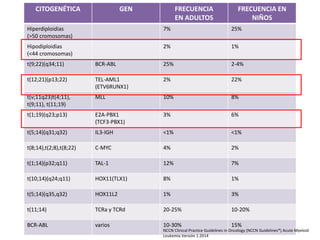
Este documento proporciona una descripción general de la leucemia aguda. Define la leucemia aguda, discute su historia, clasificación, epidemiología, factores de riesgo, cuadro clínico, diagnóstico, factores pronósticos y tratamiento. El objetivo del tratamiento es erradicar la masa leucémica inicial, restaurar la hematopoyesis normal y alcanzar la remisión.