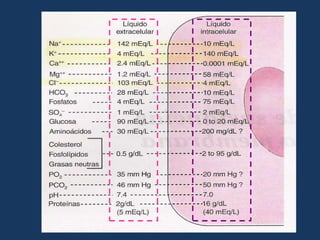
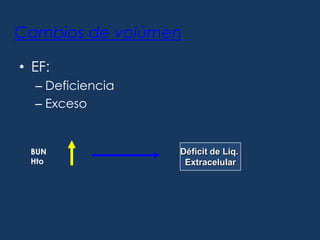
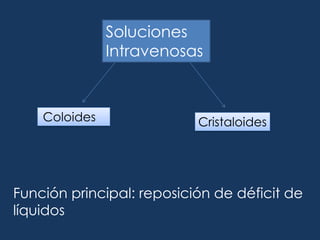
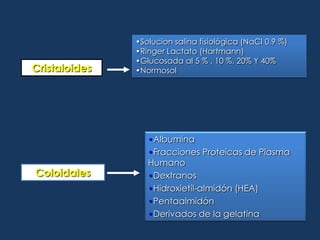
Este documento resume los líquidos y electrolitos corporales, incluyendo el agua total, los compartimentos intracelular y extracelular, y el movimiento del agua entre ellos. Explica las alteraciones de volumen, concentración y composición de los líquidos, así como las causas y tratamientos de la hiponatremia, hipernatremia, hipopotasemia e hiperpotasemia. Finalmente, revisa las soluciones intravenosas más usadas como la solución salina, solución de glucosada, y solución de Ringer lactato.











![Presión osmótica [soln] = Pparcial soluto + Pparcial solutoLa presión osmótica efectiva depende sólo de las sustancias que no pueden atravesar los poros de la membrana semipermeable:Proteínas disueltas en el plasma Causa principal de la diferencia de presión osmótica efectiva entre el plasma y líquido intersticial](https://image.slidesharecdn.com/lquidosyelectrolitos-110929150902-phpapp02/85/Liquido-sy-electrolitos-12-320.jpg)





























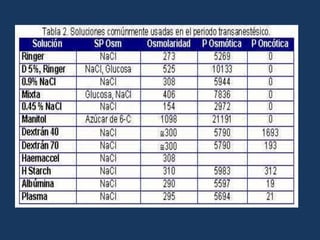


















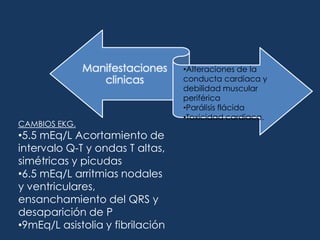




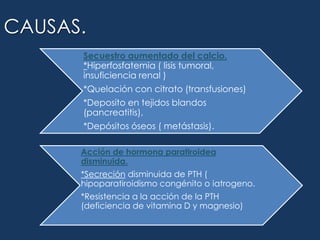













![Déficit de agua = 0.6 * peso corporal (kg) * [ sodio medido – sodio ideal / sodio medido] Durante los 2 primeros dias de tratamiento no debe reducirse el sodio mas de ½ mEq/L/h.Déficit de agua libre= Na sérico / 140 -1*agua corporal total.](https://image.slidesharecdn.com/lquidosyelectrolitos-110929150902-phpapp02/85/Liquido-sy-electrolitos-84-320.jpg)




