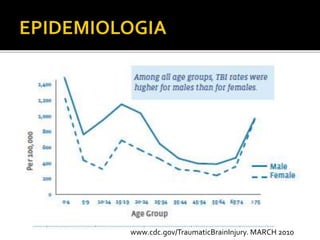
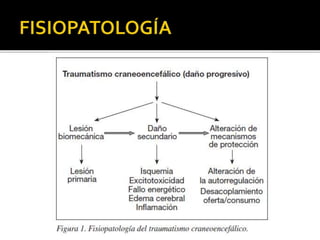
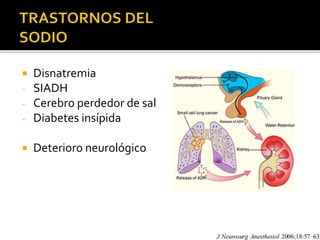
Este documento trata sobre el trauma craneoencefálico. Resume las causas, clasificación, complicaciones y manejo médico del TCE, incluyendo mantener la presión intracraneana por debajo de 20 mmHg y la presión de perfusión cerebral sobre 60 mmHg. Describe las lesiones primarias y secundarias del TCE, así como las complicaciones sistémicas como las respiratorias, cardiovasculares, endocrinas y renales.