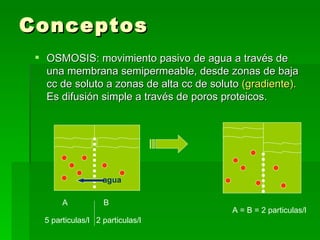
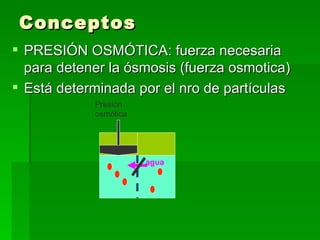
Este documento trata sobre conceptos básicos de membranas y osmolaridad. Explica que las membranas celulares regulan el intercambio de sustancias y mantienen la composición constante dentro y fuera de las células. También define conceptos como osmosis, osmolaridad, presión osmótica y tonicidad, y cómo estos afectan el movimiento de agua entre compartimentos con diferentes concentraciones iónicas y de solutos.