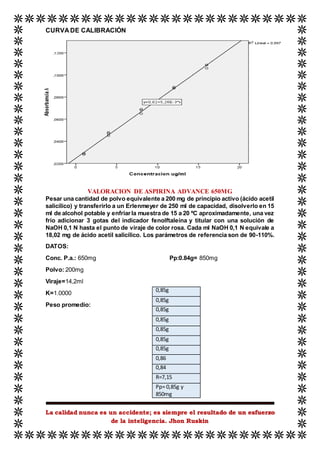
Este documento presenta el procedimiento para evaluar la calidad de ácido acetilsalicílico en diferentes formas farmacéuticas sólidas mediante métodos analíticos. Se realizaron ensayos de valoración volumétrica de muestras de cardioaspirina, Asawin pediátrico, aspirina de 100 mg y 81 mg, y aspirina Advance de 650 mg usando NaOH como titulante. También se desarrolló una curva de calibración de vitamina C mediante espectrofotometría para determinar su concentración.