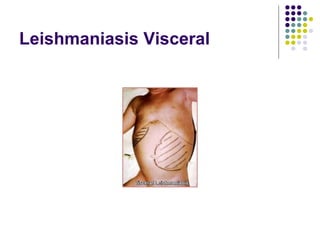
El documento describe el caso clínico de una paciente de 48 años que acude a urgencias con fiebre, malestar general y dolor abdominal. Tras varios exámenes, incluyendo hemograma, bioquímica, serología, ecografía abdominal y TAC, se diagnostica leishmaniasis visceral. La paciente es tratada con Ambisome y tiene una buena evolución clínica.

















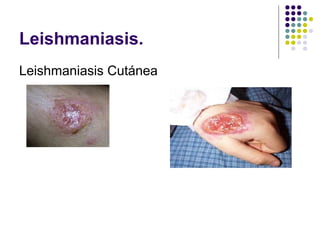











![Leishmanisis Cutanea
Diagnostico ( cutanea)
Biopsia (visualizacion directa del parasito)
Intradermoreaccion de Montenegro:
Valora la respuesta inmunitaria, Lectura A las 48 y 72 h. La positividad indica
una infección activa o pasada.
La SEROLOGÍA (inmunofluorescencia, aglutinación directa y
enzimoinmunoabsorción ligada a enzimas [ELISA]) no tiene interés en las
formas cutáneas por falta de sensibilidad y especificidad.](https://image.slidesharecdn.com/casoclinico-161030222826/85/Caso-clinico-31-320.jpg)





