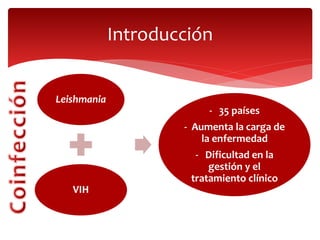
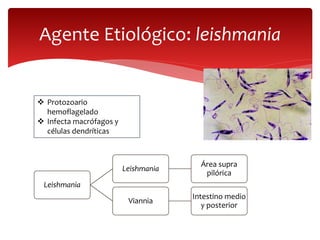
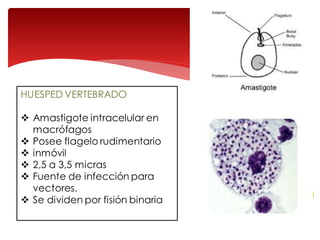
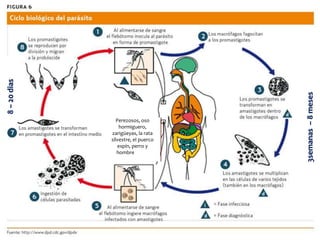
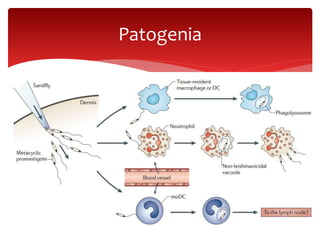
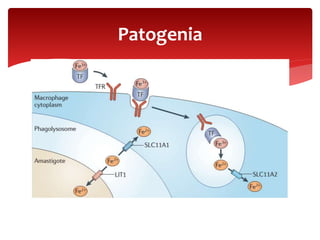
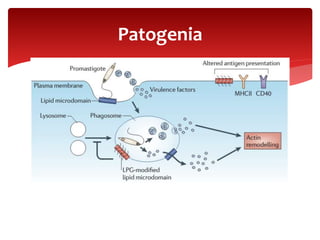
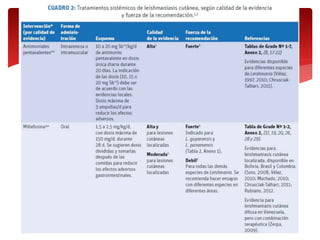
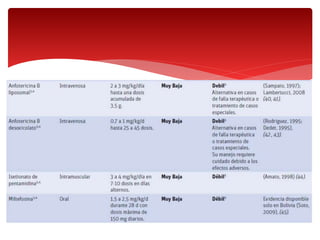
Las leishmaniasis son enfermedades parasitarias causadas por protozoos del género Leishmania que afectan la piel, las mucosas y los órganos internos. Más de 12 millones de personas están infectadas y 350 millones están en riesgo en 98 países endémicos. Existen tres formas clínicas principales: cutánea, mucocutánea y visceral. El diagnóstico se realiza mediante métodos directos, cultivo e inmunológicos y el tratamiento depende de la forma clínica y el estado del