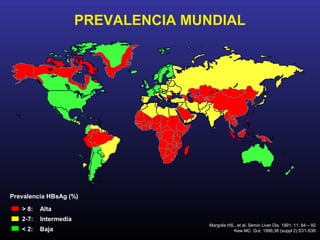
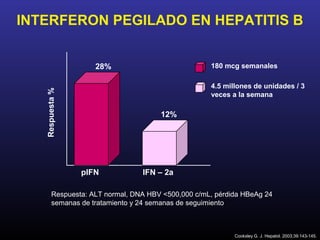
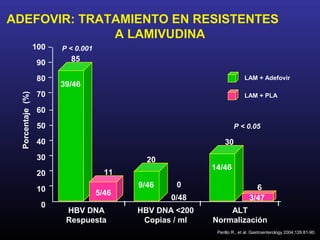
Este documento describe la hepatitis B crónica, incluyendo su genoma, genotipos, subtipos, distribución geográfica, mutaciones frecuentes, prevalencia mundial, modos de transmisión, historia natural, diagnóstico, pacientes con aminotransferasas normales, utilidad de marcadores serológicos y moleculares, determinación de serotipos y genotipos, biopsia hepática, índice de actividad, clasificación de Child-Pugh, agente ideal para el tratamiento y eficacia del interferón alfa