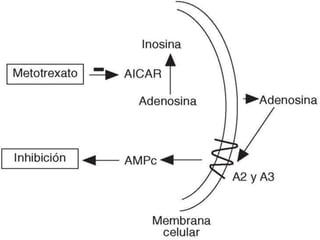
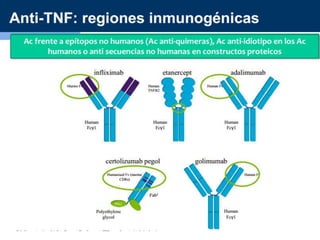
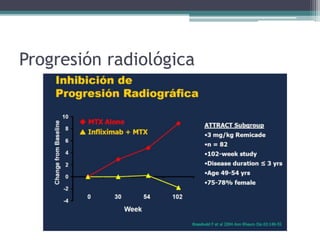
Este documento resume información sobre la artritis reumatoide (AR), una enfermedad autoinmune que afecta principalmente las articulaciones. Describe los criterios actuales para el diagnóstico de AR, los fármacos utilizados en el tratamiento como el metotrexato y los agentes biológicos, y los avances recientes en el tratamiento de la AR que han mejorado los resultados y la calidad de vida de los pacientes.