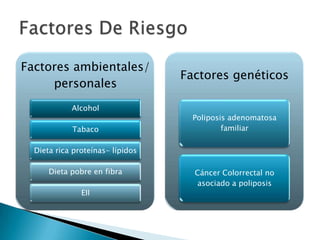
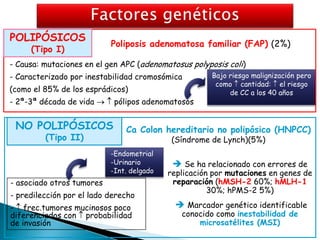
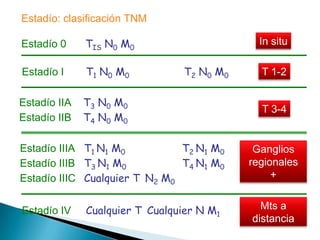
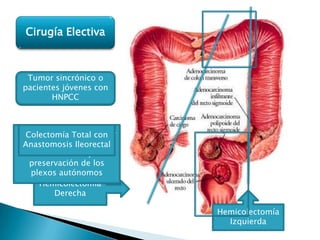
Este documento resume información sobre el cáncer colorrectal, incluyendo estadísticas, factores de riesgo, síntomas, diagnóstico, clasificación, tratamiento quirúrgico y de quimioterapia. Describe las diferentes etapas del cáncer colorrectal según la clasificación TNM y sus tasas de supervivencia respectivas. También aborda los protocolos de detección y screening recomendados según los factores de riesgo de cada paciente.