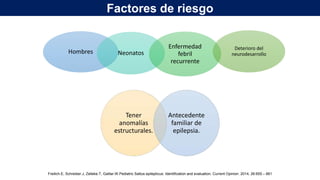
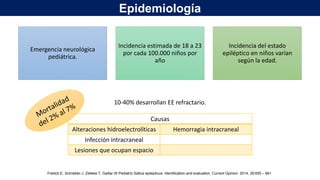
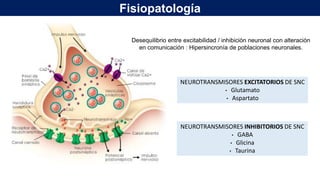
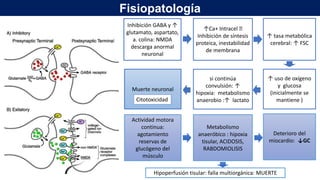
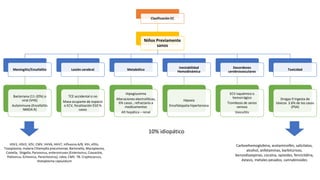
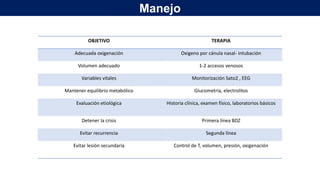
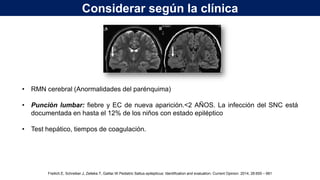
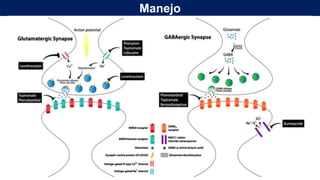
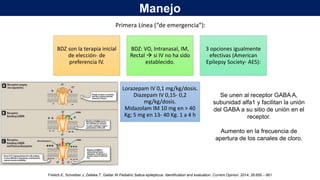
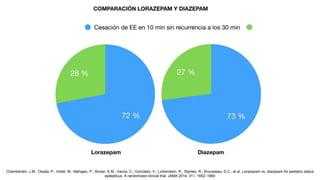
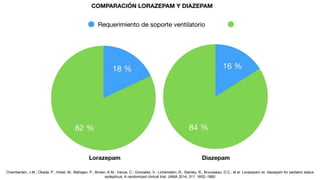
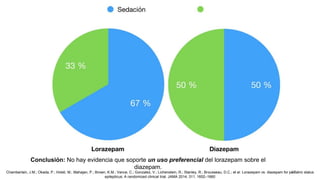
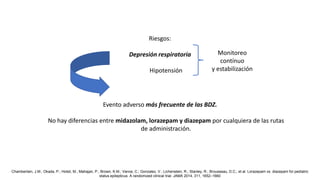
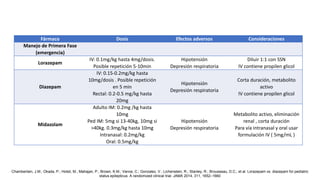
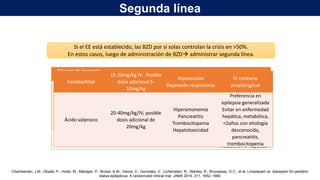
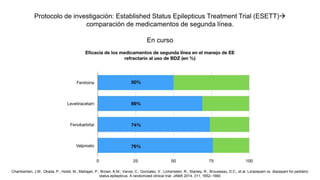
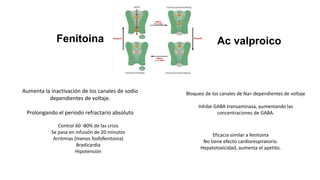
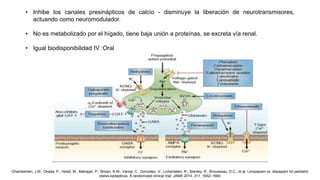
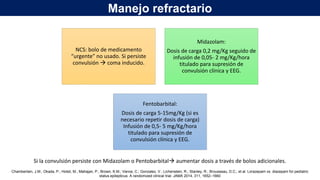
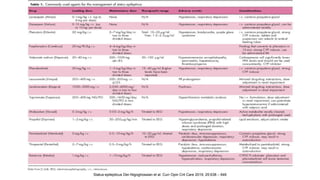
El documento presenta información sobre el estado epiléptico en pediatría. En 3 oraciones o menos:
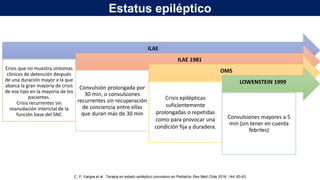
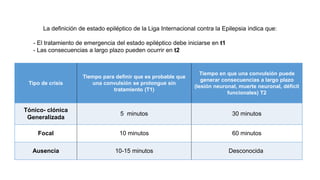
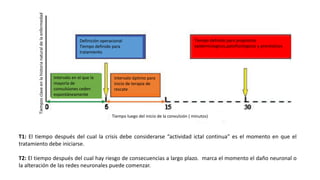
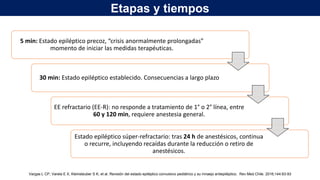
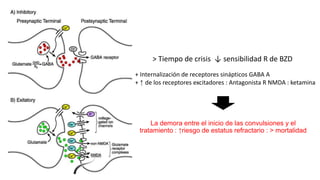
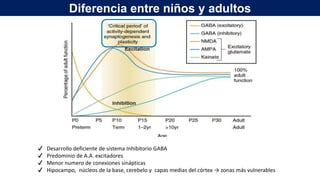
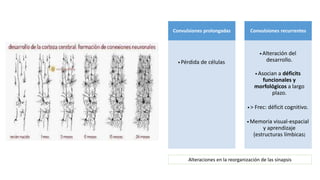
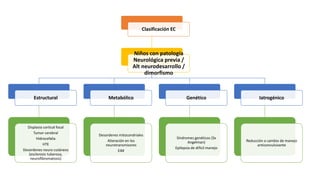
1) Define el estado epiléptico como una condición que resulta de la falla de los mecanismos de terminación de las crisis o del inicio de mecanismos que conducen a crisis anormalmente prolongadas, pudiendo tener consecuencias a largo plazo como muerte neuronal o lesión neuronal.
2) Explica que la Liga Internacional contra la Epilepsia establece tiempos clave (T1 y T2) para el tratamiento de emer