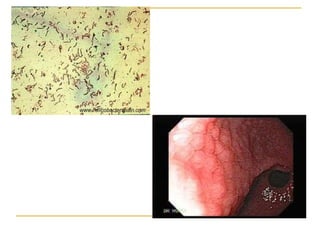
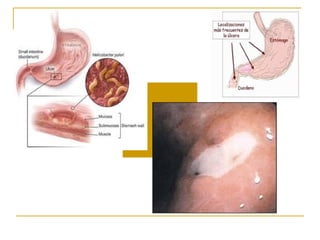
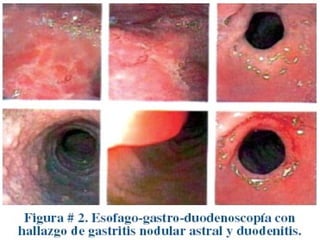
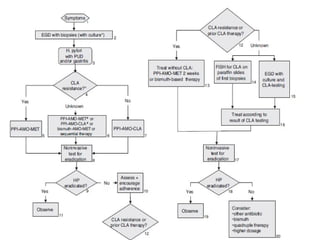
1) El documento presenta las recomendaciones actualizadas de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) y la Sociedad Norteamericana de Gastroenterología, Hepatología y Nutrición Pediátrica (NAPSGHAN) sobre el manejo de la infección por H. pylori en niños. 2) Se recomienda evaluar a niños con familiares de primer grado con cáncer gástrico o anemia ferropénica refractaria para detectar H. py