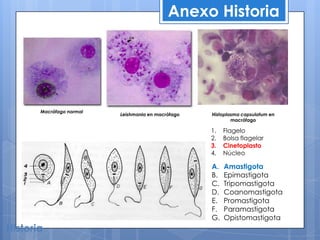
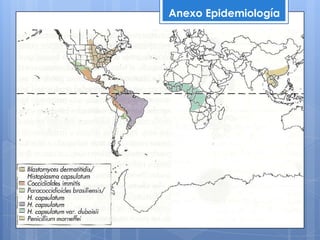
Histoplasma capsulatum fue descubierto en 1905. Es un hongo dimórfico que puede presentarse como levadura o filamento que infecta los macrófagos pulmonares. Se encuentra en suelos contaminados con guano de aves y murciélagos en zonas cálidas y templadas de América, África y Asia. Puede causar histoplasmosis, una infección generalmente asintomática pero que en personas inmunocomprometidas puede diseminarse a otros órganos. Su diagnóstico incluye cultivo, histopatología e in