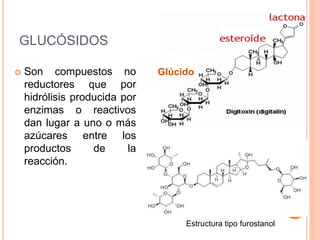
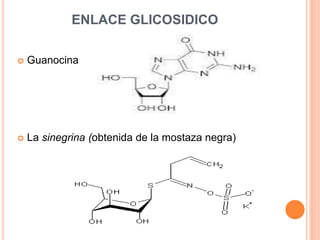
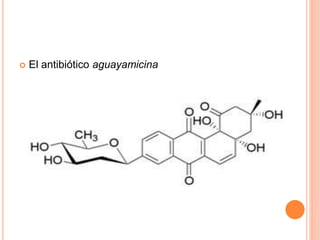
El documento describe los glucósidos, compuestos formados por la unión de un azúcar (glicona) a otra molécula (aglicona). Los glucósidos se clasifican según la estructura de la aglicona, como los glucósidos antraquinónicos, fenólicos, flavónicos o cardíacos. La unión entre la glicona y aglicona suele ser un enlace O-glucosídico y los glucósidos se hidrolizan mediante enzimas para separar sus componentes.